
A、 |
B、 |
C、 |
D、 |


科目:高中化学 来源: 题型:
| A、标况下,11.2L SO3所含的分子数目为0.5 NA |
| B、室温下,1L pH=1的稀硫酸溶液中,由水电离的H+离子数目为0.2NA |
| C、铅蓄电池放电时,正极消耗4mol H+,则电路中通过的电子数目为2NA |
| D、8 Al+3 NH4ClO4═4 Al2O3+3NH3+3HCl 反应中,消耗27gAl粉时,转移的电子数目为2.75NA(Al原子量-27) |
查看答案和解析>>
科目:高中化学 来源: 题型:
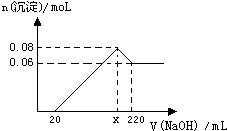 现有MgO和Al2O3的固体混合物,向其中加入100mL 2moL?L-1稀盐酸,充分反应后向溶液中逐滴加入 1moL?L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:
现有MgO和Al2O3的固体混合物,向其中加入100mL 2moL?L-1稀盐酸,充分反应后向溶液中逐滴加入 1moL?L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液体积之间的关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当Y是金属时,X可能是金属,也可能是非金属 |
| B、当X、Y都是非金属时,Y的非金属性一定比X强 |
| C、当X、Y都是金属时,Y的金属性一定比X强 |
| D、当Y是非金属时,X可能是金属也可能是非金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
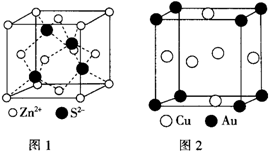 1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等.回答下列问题:
1967年舒尔滋提出金属互化物的概念,其定义为固相金属间化合物拥有两种或两种以上的金属元素,如Cu9Al4、Cu5Zn8等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
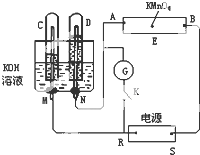 如图所示,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞.A,B分别为Pt片,压在滤纸两端,R、S为电池的电极.M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生,气体体积如图所示.
如图所示,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞.A,B分别为Pt片,压在滤纸两端,R、S为电池的电极.M、N是用多微孔的Ni的电极材料,它在碱溶液中可以视为惰性电极.G为电流计,K为开关.C、D和电解池中都充满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生,气体体积如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com