
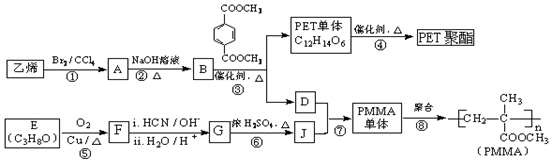
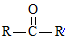 $→_{ii.H_{2}O/H+}^{i.HCN/OH-}$
$→_{ii.H_{2}O/H+}^{i.HCN/OH-}$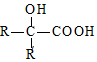 (R、R′代表烃基)
(R、R′代表烃基) .
. .
. 分析 由PMMA的结构,可知PMMA单体为CH2=C(CH3)COOCH3,则D、J分别为CH2=C(CH3)COOH、CH3OH中的一种,乙烯和溴发生加成反应生成A为CH2BrCH2Br,A在NaOH水溶液、加热条件下发生水解反应生成B为HOCH2CH2OH,根据信息I及PET单体分子式,可知PET单体为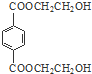 ,则D为CH3OH、J为CH2=C(CH3)COOH,PET单体发生信息I中交换反应进行的缩聚反应生成PET树脂为
,则D为CH3OH、J为CH2=C(CH3)COOH,PET单体发生信息I中交换反应进行的缩聚反应生成PET树脂为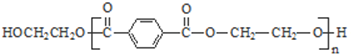 .E氧化得F,F的核磁共振氢谱显示只有一组峰,F发生信息Ⅱ中的反应得G,G在浓硫酸作用下发生消去反应得J,则E为
.E氧化得F,F的核磁共振氢谱显示只有一组峰,F发生信息Ⅱ中的反应得G,G在浓硫酸作用下发生消去反应得J,则E为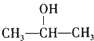 ,F为
,F为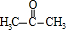 ,G为
,G为 ,据此解答.
,据此解答.
解答 解:(1)根据上面的分析可知,G为 ,G的官能团名称是羟基、羧基;故答案为:羟基、羧基;
,G的官能团名称是羟基、羧基;故答案为:羟基、羧基;
(2)根据上面的分析可知,②为A在NaOH水溶液、加热条件下发生水解反应生成B为HOCH2CH2OH,化学方程式为  ,
,
故答案为: ;
;
(3)⑥为G在浓硫酸作用下发生消去反应得J,反应类型是消去反应,故答案为:消去反应;
(4)J的结构简式为:CH2=C(CH3)COOH,则J的某种同分异构体与J具有相同官能团,其结构简式是CH3CH=CHCOOH或者CH2=CHCH2COOH,故答案为:CH3CH=CHCOOH或者CH2=CHCH2COOH;
(5)由PMMA的结构,可知PMMA单体为CH2=C(CH3)COOCH3,故答案为:CH2=C(CH3)COOCH3;
(6)a.⑦为CH2=C(CH3)COOH与HOCH3发生酯化反应,故a正确;
b.D为HOCH3,B为HOCH2CH2OH,它们的羟基的数目不同,所以B和D不是互为同系物,故b错误;
c.D中有羟基,能形成氢键,所以D的沸点比同碳原子数的烷烃高,故c正确;
故选ac;
(7)F的核磁共振氢谱显示只有一组峰,则E为 ,F为
,F为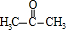 ,所以反应⑤的化学方程式为
,所以反应⑤的化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,注意根据充分利用题中信息和有机物的结构进行推断,明确有机物的官能团及其性质是解本题关键,难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在同温同压下,相同体积的任何气体单质所含的分子数目一定相同 | |
| B. | 1L 0.5mol/L FeCl3溶液完全转化可得0.5NA个Fe(OH)3胶粒 | |
| C. | 标准状况下,22.4L苯含有的分子数为1NA | |
| D. | 在常温常压下,11.2 L氮气所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中能与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含Fe3+和NO3-,无I-和Cl- | B. | 含I-,不含Fe3+、NO3-,可能有Cl- | ||
| C. | 含NO3-,不含Fe3+、I-,可能有Cl- | D. | 含I-、Fe3+,不含Cl-,可能有NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com