


科目:高中化学 来源: 题型:阅读理解
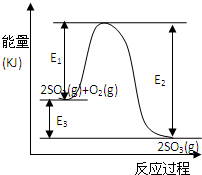 T℃时反应2SO2(g)+O2(g)
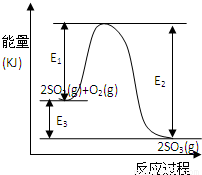
T℃时反应2SO2(g)+O2(g) 2SO3(g)过程中的能量变化如图所示,回答下列问题.
2SO3(g)过程中的能量变化如图所示,回答下列问题. 2SO3(g)△H=-E3kJ/mol 或△H=-(E2-E1)kJ/mol
2SO3(g)△H=-E3kJ/mol 或△H=-(E2-E1)kJ/mol 2SO3(g)△H=-E3kJ/mol 或△H=-(E2-E1)kJ/mol
2SO3(g)△H=-E3kJ/mol 或△H=-(E2-E1)kJ/mol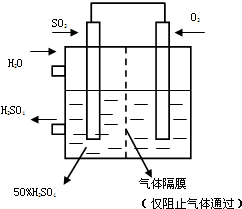
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)?2SO3(g)过程中的能量变化如图所示,回答下列问题.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)?2SO3(g)过程中的能量变化如图所示,回答下列问题.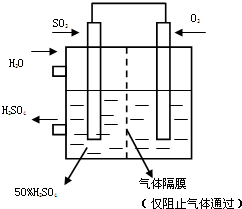
查看答案和解析>>
科目:高中化学 来源:101网校同步练习 高三化学 山东科学技术出版社 鲁教版 题型:058
实验室用如图所示装置制取乙酸乙酯.
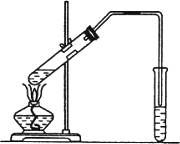
(1)在大试管中配制一定比例的乙醇、乙酸和浓H2SO4的混合液的方法是_______.
(2)加热前,大试管中加入几粒碎瓷片的作用是________;导气管不能插入饱和Na2CO3溶液中是为了________.
(3)浓H2SO4的作用是:
①________________;
②________________________.
(4)饱和Na2CO3溶液的作用是________________.
(5)实验生成的乙酸乙酯,其密度比水________(填“大”“小”),有________气味.
(6)若实验中温度过高,温度达170℃,副产物中主要有机产物是________(填名称).
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

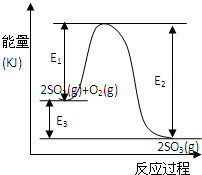
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖北省“9+4”联考高一(下)期中化学试卷(解析版) 题型:解答题
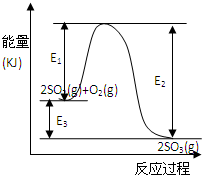
 2SO3(g)过程中的能量变化如图所示,回答下列问题.
2SO3(g)过程中的能量变化如图所示,回答下列问题.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com