
| X | L层电子数是K层电子数的3倍 |
| Y | 核外电子层数等于原子序数 |
| Z | L层电子数是K层和M层电子数之和 |
| W | 共用三对电子形成双原子分子,常温下为气体单质 |
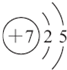 .
.分析 X元素原子的L层电子数是K层电子数的3倍,可知L层为6个电子,所以X为氧元素,Y元素原子的核外电子层数等于原子序数,Y只能是H元素,Z 元素原子的L层电子数是K层和M层电子数之和,其M层电子数为6,所以Z是S元素,W元素原子共用三对电子形成双原子分子,常温下为气体单质,所以W为N元素.
解答 解:X元素原子的L层电子数是K层电子数的3倍,可知L层为6个电子,所以X为氧元素,Y元素原子的核外电子层数等于原子序数,Y只能是H元素,Z 元素原子的L层电子数是K层和M层电子数之和,其M层电子数为6,所以Z是S元素,W元素原子共用三对电子形成双原子分子,常温下为气体单质,所以W为N元素.
(1)W为N元素,原子核外有2个电子层,最外层电子数为5,原子结构示意图为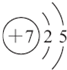 ,
,
故答案为: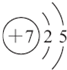 ;
;
(2)X为O,Z为S,位于同一主族,非金属性O>S,可根据反应S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2或2H2S+O2═2H2O+2S证明,
故答案为:O;S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2或2H2S+O2═2H2O+2S;
(3)X、Y、Z、W四种元素形成的一种离子化合物,可为(NH4)2SO4或NH4HSO4,其水溶液显强酸性,应为NH4HSO4,在水溶液中的电离方程式:NH4HSO4=NH4++H++SO42-,
故答案为:NH4HSO4;NH4HSO4=NH4++H++SO42-;
(4)元素X和元素Y以原子个数比1:1化合形成的化合物Q为H2O2,元素W和元素Y化合形成的化合物M,Q和M的电子总数相等,M为N2H4,以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的,且在自然界中稳定存在的物质,应生成氮气和水,反应的化学方程式为:N2H4+2H2O2$\frac{\underline{\;点燃\;}}{\;}$N2+4H2O,
故答案为:N2H4+2H2O2$\frac{\underline{\;点燃\;}}{\;}$N2+4H2O.
点评 本题考查原子结构和元素周期律的相互关系,题目难度中等,正确推断元素为解答该题的关键,熟练掌握元素化合物知识.


科目:高中化学 来源: 题型:选择题
| A. | 浓度相同的NaNO3溶液和HNO3溶液中NO3-化学性质相同 | |
| B. | 等质量的红磷和白磷完全燃烧生成P2O5(s)放出热量相同 | |
| C. | 可以通过化学反应将淀粉转化为乙酸 | |
| D. | 同温下,等体积pH相同的NH4Cl溶液和HCl溶液中由水电离出的H+数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
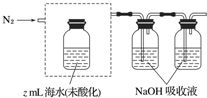
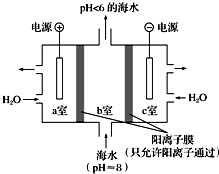
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
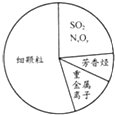
| A. | SO2、NxOy都属于酸性氧化物 | |
| B. | 碳氢化合物和氮氧化合物可引起光化学烟雾 | |
| C. | 重金属离子可导致蛋白质变性 | |
| D. | 汽车尾气的大量排放是造成雾霾天气的人为因素之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ④ | ⑤ | ||||||
| 3 | ① | ② | ③ | ⑥ | ⑦ | ⑧ |
| 实验步骤 | 实验现象 |
| A、将一小块单质①放入滴有酚酞溶液 的冷水中 | 剧烈反应,①浮于水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| B、将单质②投入冷水中,观察现象, 再将水加热 | 开始无现象,加热后有气体产生 |
| C、将单质②投入稀盐酸中 | 迅速产生大量无色气体 |
| D、将单质③投入稀盐酸中 | 反应不十分剧烈,产生无色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=Q2=Q3 | B. | Q2>Q1>Q3 | C. | Q2>Q3>Q1 | D. | Q2=Q3>Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,比钒质子数大1的元素原子的电子排布式为1s22s22p63s23p63d54s1.
,比钒质子数大1的元素原子的电子排布式为1s22s22p63s23p63d54s1.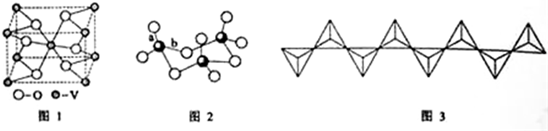
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 方案 | 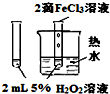 | 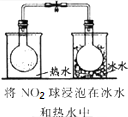 | 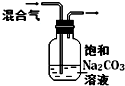 | 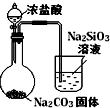 |
| 实验 目的 | 验证FeCl3对H2O2分解反应有催化作用 | 探究温度对平衡2NO2→N2O4的影响 | 除去CO2气体中混有的SO2 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com