
【题目】25℃时,将0.1 mol/L的NaOH溶液滴入盛有50 mLpH=2 的HA溶液的绝热容器中,加入NaOH溶液的体积V与溶液温度T的关系如图。下列说法正确的是( )
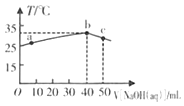
A.a点溶液中,c(A-)+c(HA)=0.08 mol/L
B.b点溶液中,c(A-)<c(Na+)
C.a→b的过程中,发生了吸热反应
D.溶液中HA的电离平衡常数a点等于b点
【答案】B
【解析】
由图象可知,加入NaOH 40 mL时温度最高,说明恰好完全反应,则50 mLHA的物质的量为0.1 mol/L×0.04L=0.004 mol,c(HA)=![]() =0.08 mol/L,而溶液的pH=2,说明HA为弱电解质,以此解答该题。
=0.08 mol/L,而溶液的pH=2,说明HA为弱电解质,以此解答该题。
A.a点溶液中,溶液的体积为50mL+10mL=60mL,c(A-)+c(HA)=![]() =0.067 mol/L,A错误;
=0.067 mol/L,A错误;
B.b点时酸、碱恰好完全反应,生成强碱弱酸盐,由以上分析可知HA为弱电解质,因此溶液中A-发生水解反应而消耗,最终达到平衡时:溶液呈碱性,则c(A-)<c(Na+),B正确;
C.a到b的过程发生酸碱中和反应,酸、碱中和反应为放热反应,C错误;
D.弱电解质在溶液中存在电离平衡,升高温度,促进弱电解质的电离,电离常数增大,所以电离平衡常数:b点>a点,D错误;
故合理选项是B。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】能源问题是人类社会面临的重大课题。甲醇是未来重要的绿色能源之一。
(1)已知:在25℃、101kPa下,1mol甲烷燃烧生成CO2和液态水时放热890.31kJ。请写出甲烷燃烧热的热化学方程式__________。
(2)由CO2和H2合成甲醇的化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g).在其他条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大300℃) 。
CH3OH(g)+H2O(g).在其他条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大300℃) 。
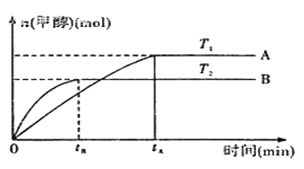
①合成甲醇反应的△H__________(填“>”、“<”或“=”)0。
②平衡常数的表达式为:__________。温度为T2时的平衡常数__________(填“>”、“<”或“=”)温度为T1时的平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)原子序数大于4的主族元素A和B的离子Am+和Bn-它们的核外电子排布相同,据此推断:
①A和B所属周期数之差为___________
②A和B的核电荷数之差为____________(用含m、n的代数式表示)
③B和A的族序数之差为______________(用含m、n的代数式表示)
(2)A、B两元素,A的原子序数为x,A和B所在周期包含元素种类数目分别为m和n。回答下列问题:
①如果A和B同在ⅠA族,当B在A的上一周期时,B的原子序数为_____________;当B在A的下一周期时,B的原子序数为______________;
②如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为___________当B在A的下一周期时,B的原子序数为______________。
(3)某粒子的结构示意图为: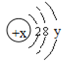 试回答:
试回答:
①当x-y=10时,该粒子为________(填“原子”或“阳离子”“阴离子”)
②当y=8时,该粒子可能是(写名称):_______、________、_______、_______、_______。
③写出y=3与y=7的元素最高价氧化物对应水化物发生反应的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是![]()
A.![]() 的溶液不一定呈中性
的溶液不一定呈中性
B.除去氯化镁溶液中的氯化铁杂质,可加入碳酸镁调节pH
C.强碱滴定弱酸可选用酚酞作指示剂,滴定终点现象是无色突变为粉色
D.![]() 时,某溶液中由水电离产生的
时,某溶液中由水电离产生的![]() ,该溶液
,该溶液![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、碳等元素的单质及其化合物在化工医药、材料等领域有着广泛的应用。回答下列问题:
(1)Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为___,所含非金属元素的电负性由大到小的顺序为___。碳原子为____杂化,NO3-的空间构型为____。
(2)目前发现的铝原子簇Al13的性质与卤素相似,则原子簇Al13属于____晶体。Na[Al(OH)4]存在的化学键有 ___(填字母)。
A 离子键 B 极性键 C 非极性键 D 配位键 E 氢键 F 金属键
(3)已知:

反应后,当σ键增加了1 mol时,π键___(填“增加”或“减少”)了____个。
(4)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键”,可表示成π34,则![]() (咪唑)中的“离域兀键”可表示为_______
(咪唑)中的“离域兀键”可表示为_______
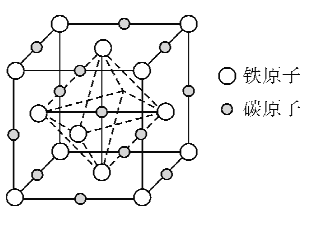
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,晶胞为面心立方结构,如图所示。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子之间的距离为_____ pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol NH3。下列对这四种气体的关系从小到大表示不正确的是
A.体积:④<①<②<③B.密度:①<④<③<②
C.质量:④<①<③<②D.氢原子数:②<④<③<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.氯化钴溶液中存在平衡,![]() 粉红色
粉红色![]() 蓝色
蓝色![]() ,将氯化钴溶液置于冰水浴,溶液变成粉红色,则可知:
,将氯化钴溶液置于冰水浴,溶液变成粉红色,则可知:![]()
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.为了减小中和滴定的误差,锥形瓶必需洗净并烘干后才能使用
D.物质的分离提纯方法之一为“筛分”:如胶体![]() 半透膜法分离提纯;悬浊液
半透膜法分离提纯;悬浊液![]() 过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子”
过滤分离,本质上就是依据所分离粒子的直径大小选择具有合适孔径的“筛子”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
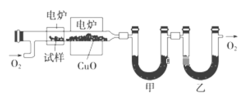
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收.2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3 (如图Ⅰ)
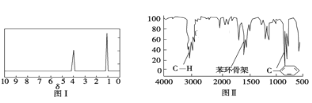
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ,试回答:
(1)步骤二中的仪器分析方法称为_________________。
(2)X的分子式为_____________;X的结构简式为___________ ;
II.某气态烷烃和气态单烯烃组成的混合气体,其密度是同条件下H2密度的13倍,把标准状况下2.24L,该混合体通入足量的溴水中,溴水增重1.4g。
(1)该混合烃的平均摩尔质量为__________;其中一定含有__________(写名称)。
(2)通过计算,确定另一种烃的分子式为_____________________ 。
(3)写出该混合烃中单烯烃所有可能的异构体(考虑顺反异构)__________________________________ 。
Ⅲ. 已知: ,如果要合成
,如果要合成![]() ,所用的原料可以是___________
,所用的原料可以是___________
A. 2-甲基-l,3-丁二烯和2-丁炔 B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔 D. 2,3-二甲基-l,3-丁二烯和丙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种常见单质,其中A、C为气体,B为常见金属.A溶于水所得的溶液可使紫色石蕊先变红后褪色.F的水溶液为浅绿色,其转化关系如图所示,请回答:
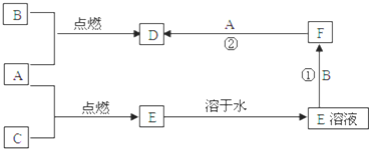
(1)![]() 和C燃烧的现象是______.
和C燃烧的现象是______.
(2)![]() 的化学式是______,检验F水溶液中金属阳离子的方法是______.
的化学式是______,检验F水溶液中金属阳离子的方法是______.
(3)反应![]() 的离子方程式是______.
的离子方程式是______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com