
【题目】下列各组离子,在强碱性溶液中能大量共存的是( )
A. Na+、Ba2+、Cl-、SO42-B. Na+、Ba2+、AlO2-、NO3-
C. NH4+、K+、Cl-、NO3-D. Na+、K+、SiO32-、SO42-
科目:高中化学 来源: 题型:
【题目】下列表述正确的是( )
A.氢氧根离子的电子式是 ![]()
B.二氧化碳分子的比例模型是 ![]()
C.芳香烃的组成通式是CnH2n﹣6(n≥6)
D.12C和14C的原子结构示意图均可表示为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组比较不正确的是 ( )
A. 锂与水反应不如钠与水反应剧烈
B. 碱金属Li、Na、K单质都能在O2中燃烧生成过氧化物
C. 熔、沸点:Li>Na>K
D. 碱性:LiOH<NaOH<KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物与人类生产、生活密切相关.
(1)C、CO、CO2在实际生产中有如下应用:a.2C+SiO2 ![]() Si+2CO b.3CO+Fe2O3
Si+2CO b.3CO+Fe2O3 ![]() 2Fe+3CO2
2Fe+3CO2
c.C+H2O ![]() CO+H2 d.CO2+CH4
CO+H2 d.CO2+CH4 ![]() CH3COOH
CH3COOH
上述反应中,理论原子利用率最高的是 .
(2)有机物加氢反应中镍是常用的催化剂.但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2 , 为搞清该方法对催化剂的影响,查得资料:
则:①不用通入O2氧化的方法除去CO的原因是 .
②SO2(g)+2CO(g)=S(s)+2CO2(g)△H= .
(3)汽车尾气中含大量CO和氮氧化物(NO2)等有毒气体.①活性炭处理NO的反应:C(s)+2NO(g)N2(g)+CO2 (g)△H=﹣akJmol﹣1(a>0)
若使NO更加有效的转化为无毒尾气排放,以下措施理论上可行的是: . 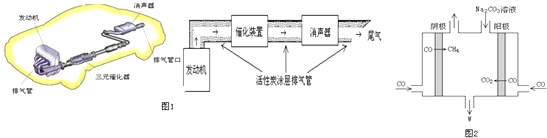
a.增加排气管长度 b.增大尾气排放口
c.添加合适的催化剂 d.升高排气管温度
②在排气管上添加三元催化转化装置,CO能与氮氧化物(NO2)反应生成无毒尾气,其化学方程式是 .
(4)利用CO2与H2反应可合成乙醚.以KOH为电解质溶液,组成乙醚﹣﹣﹣﹣空气燃料电池,该电池工作时其负极反应式是 .
(5)电解CO制备CH4和W,工作原理如图2所示,生成物W是 , 其原理用电解总离子方程式解释是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol·L-1的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“ 0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2-3次;
请回答下列问题:
(1)以上步骤有错误的是(填编号)_____________,该错误操作会导致测定结果_________ (填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00mL待测液应使用________________ (填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果____________(填“大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视_______________________;判断到达滴定终点的依据是_______。
(4)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.10 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.22 |
从上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是(______)
A.滴定前滴定管尖嘴有气泡,滴定结束无气泡
B.锥形瓶用待测液润洗
C.NaOH标准液保存时间过长,有部分变质
D.滴定结束时,俯视读数
(5)根据上表记录数据,通过计算可得,该盐酸浓度为____________mol·L-1

(6)室温下,用0.100mol/L NaOH溶液分别滴定20.00mL0.100mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是(______)
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗V(NaOH)小于20mL
C.V(NaOH) =20mL时,c( Cl- )=c(CH3COO- )
D.V(NaOH) =10mL时,醋酸溶液中:c( Na+ )> c(CH3COO-)> c( H+ )> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4﹣戊二烯和X是有机合成的基础原料,用下列方法可以合成F如图1. 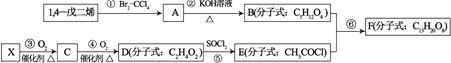
(1)已知C与新制的氢氧化铜共热生成红色沉淀;X是分子中所有原子共平面的烃.则X的结构简式为 , X在一定条件下生成的高分子化合物的结构简式为 .
(2)①的反应类型是 , F中所含官能团的名称是 .
(3)1,4﹣戊二烯最多共面的碳原子数为 , 它的一种同分异构体为 ![]() ,该有机物的系统命名为 .
,该有机物的系统命名为 .
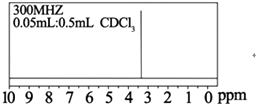
(4)与B互为同分异构体的T是有机合成的中间体,它的核磁共振氢谱如图2所示.则T的结构简式为 .
(5)反应②的化学方程式为 , 反应⑤生成物中除水外的无机物的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义.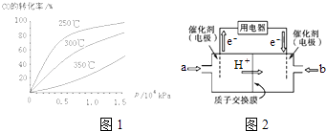
(1)NO2可用水吸收,相应的化学方程式为 . 利用反应6NO2+8NH3 ![]() 7N2+12H2O也可以处理NO2 . 当转移1.2mol电子时,消耗的NO2在标准状况下是 L.
7N2+12H2O也可以处理NO2 . 当转移1.2mol电子时,消耗的NO2在标准状况下是 L.
(2)已知:
2SO2(g)+O2(g)2SO3(g)△H=﹣196.6kJmol﹣1
2NO (g)+O2(g)2NO2(g)△H=﹣113.0kJmol﹣1
则反应NO2(g)+SO2(g)SO3(g)+NO (g) 的△H=kJmol﹣1 , 一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 .
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变 d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时的NO2与SO2体积比为1:6,则平衡常数K= .
(3)CO可用于合成甲醇,反应方程式为CO (g)+2H2(g)CH3OH (g).
①CO在不同温度下的平衡转化率与压强的关系如图1所示.该反应△H0(填“>”或“<”).实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 .
②甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的极(填“正”或“负”),其电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中不正确的是( )
A.H2SO4═2H++SO ![]()
B.Ba(OH)2═Ba2++2OH﹣
C.NaNO3═Na++NO ![]()
D.KClO3═K++Cl﹣+3O2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A. 催化剂V2O5不改变该反应的逆反应速率
B. 增大反应体系的压强,反应速率一定增大
C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com