
| A、1mol石墨转化为1 mol金刚石时要吸收1.9 kJ的热能 |
| B、1mol石墨比1 mol金刚石的能量低 |
| C、1mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
| D、石墨比金刚石稳定 |


科目:高中化学 来源: 题型:
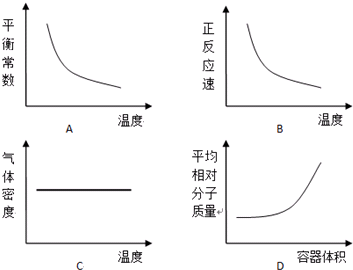
| A、对于可逆反应,若改变条件使平衡右移,则到达新的平衡时的平衡常数K一定增大 |
| B、一定温度下,在a mol?L-1的饱和石灰水中加入适量的b mol?L-1 CaCl2溶液(b>a),则一定有Ca(OH)2析出 |
| C、相同温度时,CH3COOH的电离平衡常数Ka与NH3?H2O的电离平衡常数Kb相等,所以NH4HCO3的水溶液显碱性 |
| D、升高温度,以上常数均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol | ||
B、
| ||
C、
| ||
| D、5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
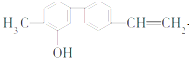
| A、一个分子中含有14个H原子 |
| B、苯环上一氯取代物有2种 |
| C、含有一种含氧官能团 |
| D、分子式是C15H14O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | H2O/mol | 放出的热量/kJ |
| 0 | 1.20 | 0.60 | 0 |
| t1 | 0.80 | Q | |
| t2 | 0.20 |
| CO | H2O | CO2 | H2 | |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0 | 0 |
| 平衡浓度(mol/L) | a | b | c | d |
查看答案和解析>>
科目:高中化学 来源: 题型:

| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com