
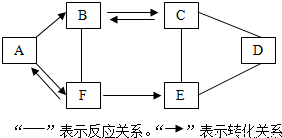
分析 根据A~F为初中化学常见的六种物质,且都含有一种相同元素,A、B、C、D、E是不同类别的物质,根据“C俗称纯碱”,所以C是碳酸钠,根据“F是人体中含量最多的物质”,所以F是水,A和水可以相互转化,所以A是氧气,氧气会转化成B,B和碳酸钠可以相互转化,所以B是二氧化碳,水会转化成E,E和碳酸钠会反应,所以E可以是氢氧化钙,氢氧化钙和碳酸钠都会与D反应,所以D可以是硫酸,然后将推出的各种物质代入转化关系中验证即可.
解答 解:A~F为初中化学常见的六种物质,且都含有一种相同元素,A、B、C、D、E是不同类别的物质,“C俗称纯碱”,所以C是碳酸钠,根据“F是人体中含量最多的物质”,所以F是水,A和水可以相互转化,所以A是氧气,氧气会转化成B,B和碳酸钠可以相互转化,所以B是二氧化碳,水会转化成E,E和碳酸钠会反应,所以E可以是氢氧化钙,氢氧化钙和碳酸钠都会与D反应,所以D可以是硫酸,氧气和氢气会生成水,水通电会生成氢气和氧气,氧气和木炭会生成二氧化碳,二氧化碳和水会发生反应,水和氧化钙会生成氢氧化钙,二氧化碳和碳酸钠可以相互转化,碳酸钠、氢氧化钙都会与硫酸反应,推出的A~F中都含有氧元素,推导合理,所以A是O2,C是Na2CO3,D是H2SO4,F是H2O;
(1)分析可知A是O2 ,D是H2SO4,F是H2O,
故答案为:O2;H2SO4;H2O;
(2)通过推导可知C是碳酸钠,其作用有制造玻璃、化学工业中制取钠盐、金属碳酸盐、漂白剂、填料、洗涤剂、催化剂及染料等,
C与E的反应是氢氧化钙和碳酸钠反应生成白色的碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
故答案为:制造玻璃;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(3)水通电生成氧气的反应是分解反应,氧气和氢气生成水的反应是化合反应,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠的反应是复分解反应,所以图中物质相互间发生的反应,未涉及的基本反应类型是:置换反应,
故答案为:置换反应.
点评 本题考查了物质性质、物质转化、物质特征反应等知识点,在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可,题目难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应中氧化剂只有FeCl3 | |
| B. | NaBH4的电子式为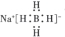 | |
| C. | NaBH4与稀硫酸不发生反应 | |
| D. | 该反应中每生成1 mol Fe,转移的电子数为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
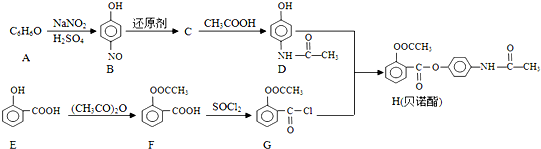
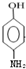 ;
;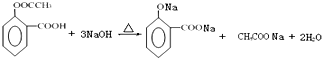 ;
;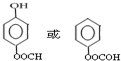 ;
;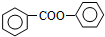 的合成路线流程图(无机试剂可任选):
的合成路线流程图(无机试剂可任选):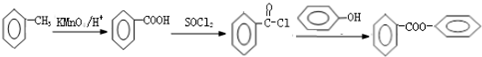 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
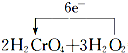 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
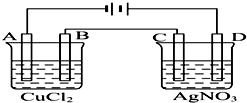 如图为以惰性电极进行电解的装置:
如图为以惰性电极进行电解的装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用高效催化剂 | B. | 充入更多N2 | C. | 降低温度 | D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com