
【题目】工业上通常采取CO(g)和![]() (g)合成
(g)合成![]() (g)
(g)
(1)已知某温度和压强下
①![]()
![]()
②![]()
![]()
③![]()
![]()
则在相同温度和压强下,CO(g)与![]() (g)合成
(g)合成![]() (g)的热化学方程式__________。
(g)的热化学方程式__________。
若反应生成6.4g甲醇,则转移电子的物质的量为__________。
(2)可利用甲醇燃烧反应设计一个燃料电池。如图,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。

①写出燃料电池负极的电极反应式__________。
②若利用该燃料电池提供电源,与图右边烧杯相连,在铁件表面镀铜,则铁件应是__________极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为__________L。
(3)电解法可消除甲醇对水质造成的污染,原理是:通电将![]() 氧化成
氧化成![]() ,然后将甲醇氧化成CO和
,然后将甲醇氧化成CO和![]() (用石墨烯除去
(用石墨烯除去![]() )现用如图所示装置模拟上述过程,则
)现用如图所示装置模拟上述过程,则![]() 在阳极的电极反应式为__________。除去甲醇的离子方程式为__________。
在阳极的电极反应式为__________。除去甲醇的离子方程式为__________。
【答案】![]()
![]() 0.8mol
0.8mol ![]() B 1.12 Co2+-e-=Co3+ Co3++CH3OH+H2O=CO2↑+6Co2++6H+
B 1.12 Co2+-e-=Co3+ Co3++CH3OH+H2O=CO2↑+6Co2++6H+
【解析】
(1)根据热化学方程式和盖斯定律计算所需热化学方程式,根据化合价变化计算转移电子数;
(2) ①甲醇燃料电池,甲醇在负极失电子发生氧化反应,碱性溶液中生成碳酸盐;
②根据电镀原理分析,待镀金属做阴极与电源负极相连,镀层金属做阳极与电源正极相连,含镀层金属离子的电解质溶液;根据电极反应和电子守恒计算得到;
(3) 通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可以知道,还原生成H+,配平书写为:Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
(1)①2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol;
②2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol;
③2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6 kJ/mol;
根据盖斯定律:①×![]() +②-③×
+②-③×![]() 得:CO(g)+2H2(g)
得:CO(g)+2H2(g)![]() CH3OH(g) △H=-128.8 kJ/mol;
CH3OH(g) △H=-128.8 kJ/mol;
由反应式CO(g)+2H2(g)![]() CH3OH(g)可知,每生成1mol甲醇转移4mol电子,所以生成6.4g甲醇,转移电子的物质的量为
CH3OH(g)可知,每生成1mol甲醇转移4mol电子,所以生成6.4g甲醇,转移电子的物质的量为![]() 4=0.8mol,
4=0.8mol,
因此,本题正确答案是:CO(g)+2H2(g)![]() CH3OH(g)△H=-128.8 kJ/mol;0.8mol;
CH3OH(g)△H=-128.8 kJ/mol;0.8mol;
(2)①用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气,甲醇在负极失电子在碱溶液中生成盐,负极的电极反应式为:![]() ;
;
因此,本题正确答案是:![]() ;
;
②利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件做电解池的阴极,阴极与电源负极连接,装置图中与甲醇相连的B电极是阴极;当铁件的质量增重6.4g时,Cu2++2e-=Cu,电子转移0.2mol,燃料电池中消耗氧气的电极反应为:O2+2H2O+4e-=4OH-,根据电子守恒计算消耗氧气物质的量为![]() =0.05mol,标准状况下体积=0.05mol×22.4L/mol=1.12L;
=0.05mol,标准状况下体积=0.05mol×22.4L/mol=1.12L;
因此,本题正确答案是:B;1.12;
(3)通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可以知道,还原生成H+,配平书写为:Co3++CH3OH+H2O=CO2↑+6Co2++6H+,
因此,本题正确答案是:Co2+-e-=Co3+;Co3++CH3OH+H2O=CO2↑+6Co2++6H+。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20mLxmol/LCH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如下图所示(忽略温度变化)。下列说法中不正确的是
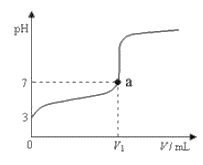
A. 上述CH3COOH溶液中:c(H+)=1×10-3mol/L
B. 图中V1<20mL
C. a点对应的溶液中,c(CH3COO-)=c(Na+)
D. 当加入NaOH溶液的体积为20mL时,溶液中:c(CH3COOH)+c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3 = 2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
A.CO2+H2O +2NaClO = Na2CO3+2HClO
B.CO2+H2O +NaClO = NaHCO3+HClO
C.CO2 +H2O +C6H5ONa![]() NaHCO3+C6H5OH
NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa![]() Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH![]() NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F.CH3COOH+NaCN = CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是_________(填编号),其pH值为_______(填数值);pH最大的是________(填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
请根据上述反应,总结出复分解反应发生的另一规律:_____________________。
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是____________________,反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W四种元素分别是元素周期表中三个连续短周期的元素,且原子序数依次增大。X、W同主族, Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键。![]() 原子的最外层电子数是次外层电子数的3倍,试推断:
原子的最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z两种元素的元素符号: X__________、Z__________。
(2)由以上元素中两两形成的化合物中,溶于水显碱性的气态氢化物的电子式为__________,它的共价键属于__________(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为__________;含有极性共价键和非极性共价键的化合物的电子式为_______。
(3)由X、Y、Z所形成的常见离子化合物是__________(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为__________;W的单质与水反应时,水作__________(填“氧化剂”或“还原剂”)。
(4)用电子式表示W与Z形成W2Z化合物的过程:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (x)、
(x)、 (y)、
(y)、![]() (z)的分子式均为C8H8,下列说法正确的是
(z)的分子式均为C8H8,下列说法正确的是
A. y的二氯代物有3种 B. x、y和z均能与溴水发生反应
C. z中的所有原子在同一平面上 D. x的同分异构体只有y和z两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地湖盐中含有![]() 等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:
等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:
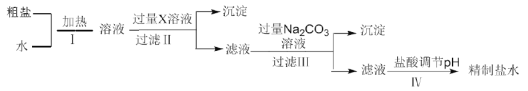
(1)过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是__________。
(2)过程Ⅱ的目的是除去![]() ,加入的X溶液是__________。
,加入的X溶液是__________。
(3)下表是过程Ⅱ、Ⅲ中生成的部分沉淀及其在20℃时的溶解度[g/100g![]() ]
]
|
|
|
|
|
|
|
|
|
|
|
|
①过程Ⅲ中生成的主要沉淀除![]() 和
和![]() 外还有__________。
外还有__________。
②过程Ⅳ中调节pH时发生的主要反应的离子方程式为__________。
(4)上述精制食盐水中还含有微量的![]() ,除去这些离子及进行电解的流程如下:
,除去这些离子及进行电解的流程如下:
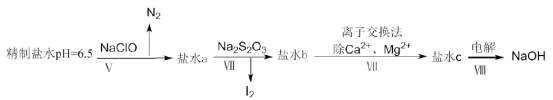
①过程Ⅴ生成![]() 的离子方程式为__________。
的离子方程式为__________。
②过程Ⅳ可以通过控制![]() 的量,将
的量,将![]() 还原为
还原为![]() ,且盐水b中含有
,且盐水b中含有![]() ,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为__________。
,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为__________。
③在过程Ⅳ中所用的![]() 俗称海波,是一种重要的化工原料。商品海波主要成分是
俗称海波,是一种重要的化工原料。商品海波主要成分是![]() .为了测定其含
.为了测定其含![]() 的纯度,称取8.00g样品,配成250mL溶液,取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为
的纯度,称取8.00g样品,配成250mL溶液,取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为![]() 的碘水滴定(发生反应
的碘水滴定(发生反应![]() ),下表记录滴定结果:
),下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 29.12 |
第二次 | 0.36 | 30.56 |
第三次 | 1.10 | 29.88 |
计算样品的纯度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g![]() Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应,下列叙述正确的是( )
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应,下列叙述正确的是( )
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03 mol·L-1·min-1
D. 当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是制取溴苯的装置。回答下列问题:

(1)装置A中发生反应的化学方程式是______________、______________。
(2)装置C中观察到的现象是______________,证明____________。
(3)装置B是吸收瓶,瓶内盛有CCl4,实验中观察到的现象是_________________,原因是___________________;如果没有装置B,将装置A、C直接相连,则该套实验装置_________(填“合理”或“不合理”),原因是___________。
(4)实验完毕后,将装置A试管中的液体倒入盛有冷水的烧杯中,烧杯_______(填“下”或“上”)层为溴苯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:

(1)化合物A是由⑤⑧两种元素构成的,用电子式表示其形成过程___________
(2)④、②元素形成的化合物的结构式__________
(3)②的最简单氢化物与氧气可以设计成燃料电池,写出在碱性条件下负极的电极方程式_____
(4)⑥的单质与⑤的最高价氧化物对应水化物的水溶液反应的离子方程式为:___________
(5)由①③⑧组成的M 物质中所含化学键的类型_________________
(6)M中的阳离子的鉴定方法是_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com