
 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物;E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题:
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物;E的阳离子与A的阴离子核外电子层结构相同.请回答下列问题: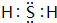 .
.分析 A、B、C、D、E五种短周期元素,根据元素在周期表中的位置知,A为第二周期元素,B、C、D为第三周期元素,设C的原子序数为x,则A的原子序数为x-8,B的原子序数为x-1,D的原子序数为x+1,相邻的A、B、C、D四种元素原子核外共有56个电子,则x-8+x-1+x+x+1=56,则x=16,所以C为S元素、A为O元素、B为P元素、D为Cl元素,E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同,则E为Al元素,再结合物质结构、物质性质分析解答.
解答 解:A、B、C、D、E五种短周期元素,根据元素在周期表中的位置知,A为第二周期元素,B、C、D为第三周期元素,设C的原子序数为x,则A的原子序数为x-8,B的原子序数为x-1,D的原子序数为x+1,相邻的A、B、C、D四种元素原子核外共有56个电子,则x-8+x-1+x+x+1=56,则x=16,所以C为S元素、A为O元素、B为P元素、D为Cl元素,E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同,则E为Al元素,
(1)A为O元素,在周期表中位置:第二周期第ⅥA族,
B为P元素,最高价氧化物化学式为P2O5,
C元素气态氢化物为H2S,电子式为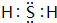 ,
,
故答案为:第二周期第ⅥA族;P2O5;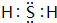 ;
;
(2)氯气与水反应方程式为:Cl2+H2O=HCl+HClO,
故答案为:Cl2+H2O=HCl+HClO;
(3)同一周期随原子半径随着原子序数增大原子半径减小,一般原子电子层数越多原子半径越大,故原子半径从小到大的顺序为O<Cl<S<P<Al,这些元素的最高价氧化物的对应水化物中HClO4酸性最强,
故答案为:O;HClO4;
(4)尾气中C的氧化物SO2的物质的量为$\frac{1120×1{0}^{3}L}{22.4L/mol}$×2%=1000mol,根据S元素守恒n(CaSO4•2H2O)=1000mol,故m(CaSO4•2H2O)=1000mol×172g/mol=173000g=172Kg,
故:理论上可以得到172千克石膏.
点评 本题考查了元素周期表和元素周期律的综合应用,涉及元素推断、物质的性质、元素周期律、化学计算等,正确推断元素是解本题关键,(4)中注意利用原子守恒解答.


科目:高中化学 来源: 题型:实验题
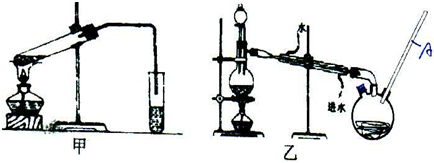
 HCOOCH3+H2O
HCOOCH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用苯萃取碘水中的碘时,将碘的苯溶液从分液漏斗下口放出 | |
| B. | Na2SiO3溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 | |
| C. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| D. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的浓度之比c(A):c(B):c(C)=2:3:4 | |
| B. | 平衡混合气体中各物质的浓度相等 | |
| C. | 平衡混合气的体积是反应开始前的$\frac{4}{5}$ | |
| D. | 单位时间内,若消耗了a mol A物质,同时也消耗了2a mol C物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.气态时,已知断裂1mol N-N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.气态时,已知断裂1mol N-N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )| A. | N4与N2互称为同位素 | |
| B. | N4属于一种新型的化合物 | |
| C. | N4化学性质比N2稳定 | |
| D. | 1mol N4气体转化为N2时要放出882kJ能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com