
【题目】装置(1)为铁镍(Fe-Ni)可充电电池:Fe+Ni2O3+3H2O ![]() Fe(OH)2+2Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,电极Y附近溶液先变红。下列说法正确的是
Fe(OH)2+2Ni(OH)2;装置(Ⅱ)为电解示意图。当闭合开关K时,电极Y附近溶液先变红。下列说法正确的是
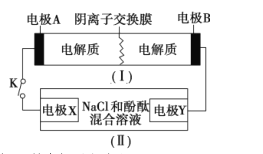
A. 闭合开关K时,电极X的电极反应式为2H++2e-===H2↑
B. 闭合开关K时,电极A的电极反应式为Ni2O3+2e-+2H++H2O===2Ni(OH)2
C. 给装置(I)充电时,电极B上参与反应的物质被氧化
D. 给装置(I)充电时,OH通过阴离子交换膜移向电极A
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),CH3OH(g) + H2O(g)![]() CO2(g) + 3H2(g)
CO2(g) + 3H2(g) ![]() H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的____________倍。
②该条件下反应达平衡状态的依据是(填序号)_______________。
A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热Q kJ。则表示甲醇燃烧热的热化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是
A.Na2CO3用于制胃酸中和剂B.FeSO4用于制补铁剂
C.硬铝合金用于制造飞机和宇宙飞船D.14C用于测定文物年代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废气中的SO2经如图中的两个循环可分别得到S和H2SO4。下列说法正确的是
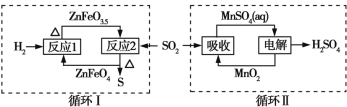
A. 循环Ⅰ中,反应1中的氧化产物为ZnFeO3.5
B. 循环Ⅰ中,反应2中的还原产物为ZnFeO4
C. Mn可作为循环Ⅱ中电解过程中的阳极材料
D. 循环Ⅰ和循环Ⅱ中消耗同质量的SO2,理论上得到S和H2SO4的质量之比为16∶49
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
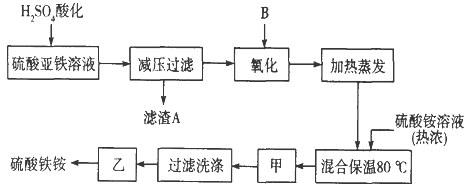
请回答下列问题:
(1)滤渣A的主要成分是__________________。
(2)下列物质中最适合的氧化剂B是________;反应的离子方程式__________________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲、乙的名称分别是:甲______________,乙___________________。
(4)上述流程中,氧化之后和加热蒸发之前,需取少量溶液检验Fe2+是否已全部被氧化,所加试剂能否用酸性的KMnO4溶液?____(填“能”或“不能”)理由是: ________________________。(可用语言或方程式说明)
(5)检验硫酸铁铵中NH4+的方法是________________________________________。
(6)称取14.00 g样品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到2.14 g沉淀;向另一份溶液中加入0.05 mol Ba (NO3) 2溶液,恰好完全反应。则该硫酸铁铵的化学式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置示意图、实验现象及结论均正确的是
A | B | |
实验 |
|
|
现象 | 溴的四氯化碳溶液褪色 | 试管b中出现分层现象 |
结论 | 石蜡油分解产物中仅含有烯烃 | 反应生成难溶于饱和碳酸钠溶液的乙酸乙酯 |
C | D | |
实验 |
|
|
现象 | 试管中有淡黄色沉淀产生 | 反应过程中钠未熔化成小球 |
结论 | 非金属性Cl>S | 反应吸热 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.2 g 铜和镁组成的混合物加入250 mL4.0 mol L-1的稀硝酸中,固体完全溶解,生成的气体只有NO。向所得溶液中加入1.0 L NaOH溶液,此时金属离子恰好沉淀完全,沉淀质量为25.4 g,下列说法不正确的是
A. 原固体混合物中,Cu和Mg的物质的量之比为2:1
B. 氢氧化钠溶液的浓度为0.8 mol·L-1
C. 固体溶解后的溶液中硝酸的物质的量为0.1mol
D. 生成的NO气体在标况下的体积为4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。
Ⅰ.用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
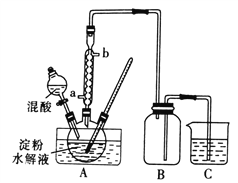
实验步骤如下
①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为3:2的65%HNO3与98%HSO4的混合物),在55~60℃下水浴加热发生反应;
③结晶、蒸发、干燥:反应后溶液经冷却、减压过滤,即得草酸晶体粗产品。
(1)装混酸的仪器名称为________;步骤②中,水浴加热的优点为__________。
(2)“②氧化”时发生的主要反应如下,完成下列化学方程式:
___C6H12O6+___HNO3 ![]() ___H2C2O4+9NO2↑+3NO↑+ ______
___H2C2O4+9NO2↑+3NO↑+ ______
(3)称取mg草酸晶体粗产品,配成100mL溶液。取20.00mL于锥形瓶中,用amoL·L-1KMnO4标准液标定,只发生
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O反应,消耗KMnO4标准液体积为VmL,则所得草酸晶体(H2C2O4·2H2O)的纯度为___________。
Ⅱ.证明草酸晶体分解得到的产物
(4)甲同学选择下述装置验证产物CO2,装置B的主要作用是__________。
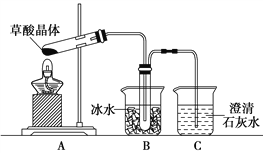
(5)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为进行验证,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。
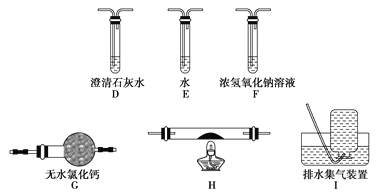
①乙同学的实验装置中,依次连接的合理顺序为A、B、_____________。其中装置H反应管中盛有的物质是________________________。
②能证明草酸晶体分解产物中有CO的现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将甲烷与氯气按1:3的体积比混合于一试管中,倒立于盛有饱和食盐水的水槽,置于光亮处(如图所示),下列有关此实验的现象和结论的叙述不正确的是( )

A. 试管中气体的黄绿色逐渐变浅,水面上升
B. 生成物只有三氯甲烷和氯化氢在标准状况下是气体
C. 试管内壁有油状液滴形成
D. 试管内有少量白雾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com