
| A、①② | B、③④ | C、②④ | D、①③ |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴加甲基橙显红色的溶液:I-、NH4+、Cl-、NO3- |
| B、含有大量AlO2-的溶液:Na+、K+、NO3-、CO32- |
| C、常温下由水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| D、含有溶质为NaHSO4的溶液:K+、SiO32-、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、可加入硫酸以提高电解质的导电性 |
| B、放电时电池内部Li+向负极移动. |
| C、充电过程中,电池正极材料的质量不变 |
| D、放电时电池正极反应为:FePO4+Li++e-=LiFePO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
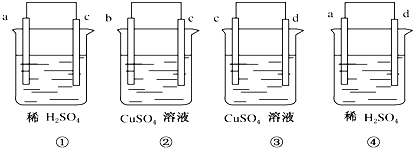
| A、d>a>c>b |
| B、b>d>c>a |
| C、d>c>a>b |
| D、a>d>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
 3H2(g)+N2(g)?2NH3(g) 反应过程中的能量变化如图所示.有关说法错误的是( )
3H2(g)+N2(g)?2NH3(g) 反应过程中的能量变化如图所示.有关说法错误的是( )| A、图中C表示生成物NH3(g)的总能量 |
| B、断裂3molH-H和1mol N≡N所吸收的总能量大于形成6mol N-H所释放的总能量 |
| C、逆反应的活化能E(逆)=E+△H |
| D、3 H2(g)+N2(g)?2NH3(g)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
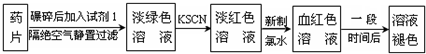
| 编号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的SCN-被过量的氯水氧化 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com