
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd+2NiO(OH)+2H2O![]() Cd(OH)2+2H2O。下列叙述中不正确的是:( )
Cd(OH)2+2H2O。下列叙述中不正确的是:( )
A. 该电池放电的时候,负极材料是Cd
B. 放电时每转移3mol的电子时,正极有3mol的NiO(OH)被氧化
C. 充电时,阴极附近pH增大
D. 充电时,阳极反应是Cd(OH)2+2e-= Cd + 2OH-
【答案】BD
【解析】放电时负极上发生的电极反应式为:Cd-2e-+2OH-=Cd(OH)2,正极上发生的电极反应式为:NiO(OH)+e-+H2O═Ni(OH)2+OH-,充电时阳极上发生的电极反应式为:Ni(OH)2+OH--e-→NiO(OH)+H2O,阴极上发生的电极反应式为:Cd(OH)2+2e-═Cd+2OH-。A.该电池放电的时候,负极材料是Cd,故A正确;B.放电时,正极上发生的电极反应式为:NiO(OH)+e-+H2O═Ni(OH)2+OH-,所以放电时每转移3mol的电子时,正极有3mol的NiO(OH)被还原,故B错误;C.阴极应被还原,阴极上发生的电极反应式为:Cd(OH)2+2e-═Cd+2OH-,所以充电时,阴极附近pH增大,故C正确;D.充电时,该装置是电解池,阳极发生氧化反应,电极反应式为:Ni(OH)2-e-+OH-═NiO(OH)+H2O,故D错误;故选BD。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】采用下列装置和操作,不能达到实验目的的是( )
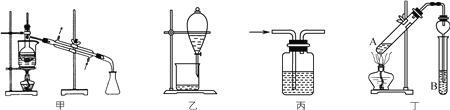
A. 甲装置:在乙醇与乙酸的混合液中加入足量生石灰,可蒸馏出乙醇
B. 乙装置:用CCl4萃取溴水中的溴,并把溴的CCl4溶液从下口放出
C. 丙装置:广口瓶中盛酸性高锰酸钾溶液,除去CH4中的少量SO2
D. 丁装置:A中为乙醇、醋酸,B为饱和碳酸钠溶液,制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH ![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的物质的量之比为5:1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法适合实验室制取氨气的是( )
A. N2和H2催化加热制取氨气
B. 加热NH4Cl制取氨气
C. 将浓氨水向氧化钙固体上滴加
D. 将NH4Cl溶液和NaOH溶液混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3S+6KOH == K2SO3+ 2K2S +3H2O中,被氧化与被还原的硫原子数之比为( )
A. 1:2B. 2:1C. 1:1D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸(HNO2)在反应中既可作氧化剂,又可作还原剂。当它作还原剂时,其氧化产物可能是( )
A. NH3 B. N2
C. NO2 D. NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的数值,下列叙述中正确的是( )
A.常温常压下,48gO3含有的氧原子数为3NA
B.24g金属镁变为镁离子时失去的电子数为NA
C.4℃时9mL水和标准状况下11.2L氮气含有相同的原子数
D.同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:

请回答下列问题:
(1)若A为H2O(g),可以得到Fe3O4,写出H2O的电子式:________________。
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+生成Fe3+的离子方程式___________________。
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共熔制得高铁酸钾的化学方程式,并配平:___________

(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00 mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1 00 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00 mL。
已知:2Fe3++2I-===2Fe2++I2 ;I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() 。
。
①写出滴定选用的指示剂________,滴定终点观察到的现象_______________________。
②溶液Ⅰ中铁元素的总含量为__________g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com