
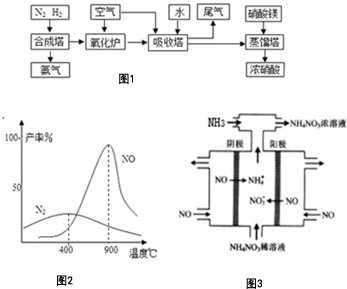
 氨、硝酸、硝酸铵、硝酸铜是重要的化工产品.工业合成氨与制备硝酸一般可连续生产,流程如图1:请回答下列问题
氨、硝酸、硝酸铵、硝酸铜是重要的化工产品.工业合成氨与制备硝酸一般可连续生产,流程如图1:请回答下列问题分析 (1)吸收塔中通入空气的作用是利用氧气将NO、NO2等氧化为硝酸;硝酸镁加入到蒸馏塔中作吸水剂据此分析;
(2)尾气中的氧化物主要为NO、NO2,由题目信息可知,二者与水反应生成亚硝酸,亚硝酸再与尿素反应生成CO2和N2,然后配平;
(3)由图可知,在800℃~900℃时,NO的产率很高;
(4)工业上电解NO制备 NH4NO3,由装置图可知阳极发生氧化反应,NO被氧化生成NO3-,阴极发生还原反应,NO被还原生成NH4+,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,结合电极方程式解答该题.
(5)根据达到平衡时,c(NO2)=0.0400mol/L,c(N2O4)=0.0100mol/L,求出5L混合气体中N2O4和NO2的物质的量,然后根据在氧化还原反应中得失电子数守恒,求出反应掉的铜的物质的量,即可求出生成光谱纯硝酸铜晶体的物质的量和质量.
解答 解:(1)吸收塔中通入空气的作用是利用空气中的氧气将NO、NO2等氧化为硝酸;硝酸镁加入到蒸馏塔中作吸水剂,浓硫酸能吸水,而且难挥发,所以选用浓硫酸,
故答案为:将NO、NO2等氧化为硝酸,A;
(2)由题目信息可知,NO、NO2二者混合物与水反应生成亚硝酸,反应方程式为NO+NO2+H2O=2HNO2;
亚硝酸再与尿素反应生成CO2和N2,反应方程式为CO(NH2)2+2HNO2═CO2↑+2N2↑+3H2O,
故答案为:NO+NO2+H2O=2HNO2;CO(NH2)2+2HNO2═CO2↑+2N2↑+3H2O.
(3)由图可知,在800℃~900℃时,副产物N2的产率较低,而NO的产率很高,
故答案为:800~900℃时副产物N2的产率较低,NO的产率很高;
(4)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3,补充氨气能将电解过程中生成的硝酸转化为硝酸铵,
故答案为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3,将电解过程中生成的硝酸转化为硝酸铵;
(5)根据达到平衡时,c(NO2)=0.0400mol/L,c(N2O4)=0.0100mol/L,故5L混合气体中的NO2的物质的量n=CV=0.04mol/L×5L=0.2mol,N2O4的物质的量n=CV=0.01mol/L×5L=0.05mol.
设反应掉的铜的物质的量为Xmol,根据铜与浓硝酸反应时得失电子数守恒,即铜失去的电子的物质的量等于硝酸得到的电子的物质的量,可得:
2X=0.2mol×1+0.05mol×2
解得X=0.15mol
而Cu~Cu(NO3)2•3H2O,故生成的Cu(NO3)2•3H2O的物质的量为0.15mol,故质量m=nM=0.15mol×242g/mol=36.3g,
故答案为:36.3g.
点评 本题考查了反应条件的控制、工业合成氨与制备硝酸、化学方程式的书写、电解原理的应用、守恒方法在化学计算中的应用的知识,题目综合性较强,难度中等,侧重于考查学生的分析能力和计算能力、以及对基础知识的综合应用能力.


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:选择题
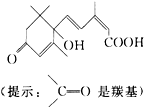
| A. | 含有碳碳双键、羟基、羰基、羧基 | B. | 含有苯环、羟基、羰基、羧基 | ||
| C. | 含有羟基、羰基、羧基、酯基 | D. | 含有碳碳双键、苯环、羟基、羰基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
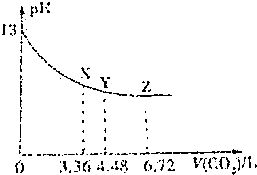
| A. | 该NaOH溶液的浓度为0.1mol/L,体积为6L | |
| B. | X、Y、Z三点对应的溶液中离子的种类不同 | |
| C. | Y点对应的融资中离子浓度关系为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| D. | Y点对应的溶液中存在着:c(Na+)=2c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度℃ | 25 | 80 | 230 |
| 平衡常数值 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述反应是熵增反应 | |
| B. | 25℃时,反应G(g)?E(s)+4F(g)的平衡常数值是0.5 | |
| C. | 在80℃时,测得某时刻,F、G浓度均为0.5 mol•L-1,则此时v(正)>v(逆) | |
| D. | 恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中含有少量Na2CO3,可以用澄清石灰水除去 | |
| B. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 | |
| C. | 加水稀释CH3COONa溶液,溶液中的所有离子浓度都减小 | |
| D. | 金属铝的生产是以Al2O3为原料,在熔融状态下进行电解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
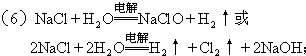 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在丙烯醛分子中,仅含有一种官能团 | |
| B. | 丙烯醛能使溴水褪色,但不能使酸性高锰酸钾溶液褪色 | |
| C. | 丙烯醛能发生加聚反应,生成高聚物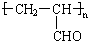 | |
| D. | 等物质的量的丙烯醛和丙醛完全燃烧,消耗等物质的量的O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com