
| A. | 吸热反应 | B. | 放热反应 | C. | 化合反应 | D. | 可逆反应 |
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu(NO3)2溶液可作电解质溶液 | |
| B. | 在电解质溶液中,电子由负极流向正极 | |
| C. | 锌极的质量先减小后增大 | |
| D. | 可用镁作正极材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
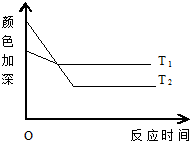 反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间、温度(t)之间的关系如图所示(B、C均为无色物质):
反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间、温度(t)之间的关系如图所示(B、C均为无色物质):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
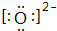 ;
;| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA | |
| B. | 1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子 | |
| C. | 由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NA | |
| D. | 6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍.在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高.请回答下列问题:
主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍.在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金 | B. | 硫磺 | C. | 黄铜 | D. | 黄铁矿 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁投入硫酸锌溶液中:Fe+Zn2+═Zn+Fe2+ | |
| B. | 钠投入硫酸铜溶液中:2Na+Cu2+═Cu+2Na+ | |
| C. | 往饱和Na2CO3溶液中逐滴加入少量稀盐酸:$CO_3^{2-}$+2H+═CO2↑+H2O | |
| D. | 钠投入冷水中:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com