
【题目】氧化铬(Cr2O3)可用作有机合成的催化剂。某课题组以铬铁矿为主要原料制备Cr2O3。铬铁矿主要成分为Fe(CrO2)2,还含有Al2O3、SiO2等杂质,工艺流程如图所示。下列说法错误的是( )
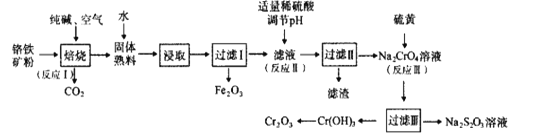
A.Fe(CrO2)2中Cr元素的化合价为+3
B.“焙烧”时,1molFe(CrO2)2参加反应转移4mole-
C.“滤渣”成份是Al(OH)3
D.“反应Ⅲ”的离子方程式为4CrO42-+6S+7H2O=4Cr(OH)3+3S2O32-+2OH-
【答案】BC
【解析】
铬铁矿为原料制备重铬酸钠,铬铁矿(主要成份为Fe(CrO2)2,还含有Al2O3、SiO2等杂质),铬铁矿经加入纯碱、空气和辅料氧化煅烧、主反应:4Fe(CrO2)2+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,副反应:SiO2+Na2CO3
8Na2CrO4+2Fe2O3+8CO2,副反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑,水浸之后除去生成的氧化铁,加入稀硫酸调节pH,除去溶液中的AlO2-、SiO32-,经酸化、蒸发结晶后后可生成重铬酸钠,加入硫磺,发生氧化还原反应生成Cr(OH)3,分解生成Cr2O3,以此解答该题。
2NaAlO2+CO2↑,水浸之后除去生成的氧化铁,加入稀硫酸调节pH,除去溶液中的AlO2-、SiO32-,经酸化、蒸发结晶后后可生成重铬酸钠,加入硫磺,发生氧化还原反应生成Cr(OH)3,分解生成Cr2O3,以此解答该题。
A.亚铬酸亚铁[Fe(CrO2)2]中Fe为+2价,O为-2价,由化合价代数和为0可知Cr的化合价是+3价,故A正确;
B.“焙烧”时,发生4Fe(CrO2)2+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,4molFe(CrO2)2参加反应需要7mol氧气,转移28mol电子,则1molFe(CrO2)2参加反应转移7mol电子,故B错误;
8Na2CrO4+2Fe2O3+8CO2,4molFe(CrO2)2参加反应需要7mol氧气,转移28mol电子,则1molFe(CrO2)2参加反应转移7mol电子,故B错误;
C.由以上分析可知,“滤渣”成份是Al(OH)3、H2SiO3,故C错误;
D.硫磺在与铬酸钠的反应中转化为硫代硫酸钠,反应的离子方程式为4CrO42-+6S+7H2O=4Cr(OH)3↓+3S2O32-+2OH-,故D正确;
答案选BC。


科目:高中化学 来源: 题型:
【题目】Ⅰ.回答下列问题:
(1)量子力学把电子在原子核外的一个空间运动状态称为一个________,还有一种状态叫做________。
(2)写出![]() 原子的外围电子排布式:______,其在周期表中的位置________,其在周期表中处于______区,与
原子的外围电子排布式:______,其在周期表中的位置________,其在周期表中处于______区,与![]() 同周期的所有副族元素的基态原子中,最外层电子数与
同周期的所有副族元素的基态原子中,最外层电子数与![]() 相同的元素有_________种。
相同的元素有_________种。
(3)下列![]() 原子电子排布图表示的状态中,能量最低和最高的分别为_______、_______(填标号)。
原子电子排布图表示的状态中,能量最低和最高的分别为_______、_______(填标号)。
A 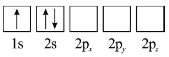 B
B 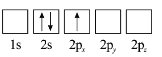
C 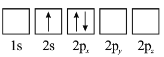 D
D 
Ⅱ.有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层![]() 能级的电子数等于次外层的电子总数, B元素可分别与A、C、D生成
能级的电子数等于次外层的电子总数, B元素可分别与A、C、D生成![]() 型化合物,并知在
型化合物,并知在![]() 中,
中,![]() 与
与![]() 的质量比为
的质量比为![]() 原子的价电子排布式为
原子的价电子排布式为![]() 。根据以上条件,回答下列问题:
。根据以上条件,回答下列问题:
(1)C的基态原子的电子占据最高能层的符号为_______,![]() 原子的价电子排布图________。
原子的价电子排布图________。
(2)A、B、C三种元素的第一电离能由大到小的顺序______(用元素符号表示)。
(3)元素B和D的电负性由大到小的顺序_________(用元素符号表示)。
(4)写出E的元素符号_________,要证明太阳光中含有E元素,可采用的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是二元弱酸,NaHC2O4溶液呈酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系错误的是( )
A.V(NaOH) = 0时,c(H+) >1×10-7mol/L
B.V(NaOH)<10 mL时,可能存在c(Na+) = 2c(C2O42-)+c(HC2O4- )
C.V(NaOH) = 10 mL时,溶液的pH为9,则10-9= 10-5-2c(H2C2O4)-c(HC2O4-)
D.V(NaOH)>10 mL时,可能存在c(OH- )>c(Na+)>c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示。
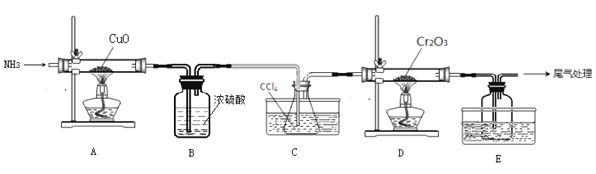
已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在高温下反应的产物为CrCl3和光气(COCl2 )。请回答下列问题:
(1)装置A是氮气制备装置,氮气的作用是____________。
(2)装置B的作用为________。装置C和装置E的水槽中应分别盛有__________、____________。
(3)装置D中生成CrCl3和光气(COCl2 )的化学方程式为_________。
(4)该实验装置有设计不合理的地方,请写出改进方法:_________(写一点即可)
(5)产品中CrCl3质量分数的测定:
(i)称取0.3000 g得到的CrCl3样品溶于水并于250mL容量瓶中定容。
(ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O72-;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在
(iii)加入1mL指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)
①ii中加入稍过量的Na2O2后要加热煮沸,其主要原因是____________;加入KI发生反应的离子方程式为________________
②滴定实验可选用的指示剂为____________产品中CrCl3质量分数为_______%(结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为Lil晶体锂电池的工作示意图,该电池具有使用寿命长、电压稳定等优点,常用于心脏起搏器的电源。下列说法错误的是( )
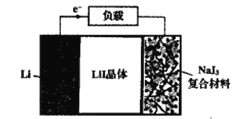
A.NaI3为电池的正极材料
B.电池工作时,Li+由NaI3移动到Li电极
C.正极电极反应为:2Li++NaI3+2e-=2LiI+NaI
D.该电池的总反应为:2Li+NaI3=2LiI+NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 M、N 是合成某功能高分子材料的中间产物,下列关于 M、N 说法正确的是
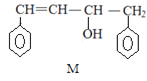
![]()
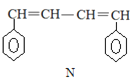
A.M、N 都属于芳香烃,但既不是同系物,也不是同分异构体
B.M、N 分别与液溴混合,均发生取代反应
C.M、N 均能使酸性高锰酸钾溶液褪色
D.M、N 分子所有原子均可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 A 是一种重要的化工原料,以 A为起始原料可合成药物 I(结构简式如下),其合成路线如下:

已知:①有机物 D 为芳香烃
②RNH2+
![]()
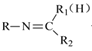 +H2O
+H2O
回答下列问题:
(1)F 的名称是_____,B 中官能团的名称是_____。
(2)由 B→C、E+H→I 的反应类型分别是_____、_____。
(3)G 的结构简式为_____。
(4)D→F 所需的试剂和反应条件是_____。
(5)G 和 CH3CHO 反应生成 H 的化学方程式为_____。
(6)芳香化合物J是 E的同分异构体。若J 能发生银镜反应,则J 可能结构有______种(不含立体异构), 其中核磁共振氢谱有四组峰,且峰面积之比为 1:1:2:6 的结构简式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通干电池是一种广泛使用的可移动化学电源。 某同学在探究废酸性干电池内物质回收利用时,进行如图所示实验:
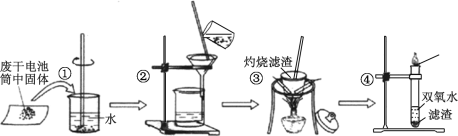
请回答以下问题:
(1)干电池工作时正极电极反应式为:2NH4++2e- = 2NH3↑+H2↑,则负极电极反应式是___________。 电池中加入 MnO2 的作用是除去正极上的某产物, 本身生成Mn2O3,该反应的化学方程式是_______________。
(2)步骤③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、______ 、泥三角和三脚架;灼烧滤渣时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质有_____。
(3)向步骤④的试管中加入步骤③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定灼烧后的黑色固体为_____。
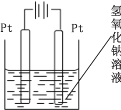
(4)查询资料得知,通过电解可将 Mn2O3 转化为 MnO2。 为此某同学设计了如图所示装置,并将混合物粉末调成糊状,附在其中的_________(填“左”或“右”)边电极上,该电极上发生反应的电极反应式是_____, 在电解过程中溶液的 pH 将__________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10min内,相同浓度的有机污染物X的降解率随pH和温度的关系如图1和图2所示。
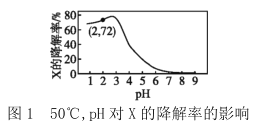
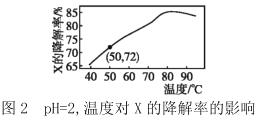
下列说法不正确的是( )
A.50℃,pH=4时X降解速率大于pH=5时的降解速率
B.由图1和图2可知,随温度的升高和pH的增大X的降解率不一定增大
C.由图1和图2可判断反应最佳条件:pH=3,温度为80℃
D.若50℃,pH=2时降解速率v(X)=1.44×10-4mol·L-1·min-1,则初始c(X)=2.0×10-3mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com