
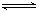 CO(g)+3H2(g)△H=-(a+b-3C)kJ.mol-1.
CO(g)+3H2(g)△H=-(a+b-3C)kJ.mol-1.
分析 (1)依据图象分析反应过程都是能量降低的过程,说明反应是放热反应;写出对应热化学方程式,依据盖斯定律计算得到所需热化学方程式;
(2)①根据25min时氨气的物质的量变为0,而氮气和氢气的物质的量不变进行解答;
②依据实际生产需要和平衡移动方向分析判断需要的条件;
(3)①依据平衡移动方向分析判断需要的条件;
②使用催化剂时,改变反应速率,不改变化学平衡,依据催化剂只加快反应速率不影响平衡浓度画出图象;
(4)①根据时段Ⅲ条件下达到平衡时各组分的浓度及平衡常数表达式进行解答;
②a依据反应转化率的大小分析,结合图象分析判断;
b根据氨气和二氧化碳的转化率之比求出x1.
解答 解:(1)图象分析反应过程都是能量降低的过程,反应的热化学方程式为:
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=+bKJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-cKJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-bKJ/mol
由盖斯定律③-②×3-①得到:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=-(a+b-3C) kJ.mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=-(a+b-3C) kJ.mol-1;
(2)①25min时氨气的物质的量迅速变为0而氮气、氢气的物质的量不变,之后氮气、氢气的物质的量逐渐减小,氨气的物质的量逐渐增大,说明25min时将NH3从反应体系中分离出去,
故答案为:将NH3从反应体系中分离出去;
②在实际制氨气工业生产中和该措施的目的相同的其它措施还有高压、原料气循环利用等方法,故答案为:高压、原料气循环利用等;
(3)①吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,依据化学平衡[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g)?[Cu(NH3)3]CH3COO•CO(l);△H<0,反应是气体体积减小的放热反应,平衡逆向进行是再生的原理,再生的适宜条件是高温低压,
故答案为:B;
②若反应延续至70s,保持其它条件不变情况下,使用催化剂时,改变反应速率,不改变化学平衡,曲线的转折点在横坐标40之前,纵坐标必需在20的线上,该反应的进程曲线为如图所示: ,
,
故答案为: ;
;
(4)①某温度下,向容积为100L的密闭容器中通入4molNH3和2molCO2,该反应进行到40s时达到平衡,此时CO2的转化率为50%,转化的二氧化碳为1mol,则:
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)
起始量(mol):4 2 0
变化量(mol):2 1 1
平衡量(mol):2 1 1
则平衡常数K=$\frac{c({H}_{2}O)}{{c}^{2}(N{H}_{3})×c(C{O}_{2})}$=$\frac{\frac{1}{100}}{(\frac{2}{100})^{2}×\frac{1}{100}}$=2500L2•mol-2,
故答案为:2500;
②a、氨碳比相同时曲线Ⅰ二氧化碳的转化率大,所以生产中选用水碳比的数值为Ⅲ,故答案为:Ⅲ;
b、由题意可知:2NH3(g)+CO2(g)?CO(NH2)2+H2O(g)
起始量 x1 1
变化量 2a a
即:$\frac{2a}{{x}_{1}}$=40%,$\frac{a}{1}$=60%,则x1=3,
故答案为:3.
点评 本题考查了热化学方程式、化学反应速率计算、影响化学平衡的因素,熟悉方法和盖斯电极计算应用,图象分析,化学平衡计算,平衡常数概念的分析应用是解题关键,侧重分析与应用能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
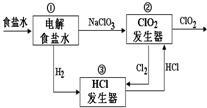 利用食盐水制取ClO2的工业流程如图所示.
利用食盐水制取ClO2的工业流程如图所示.| A. | 该流程中仅NaCl可循环利用 | |
| B. | 装置①中H2是阴极产物 | |
| C. | 装置②中Cl2是还原产物 | |
| D. | 为使H2完全转化为HCl,还应向装置③中再补充Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可作净水剂,向海水中加入明矾可以使海水淡化 | |
| B. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 | |
| C. | 臭氧是一种氧化性较强的气体,可用于自来水的消毒 | |
| D. | SO2具有还原性,可用已知浓度的KMnO4溶液测定食品中SO2残留量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
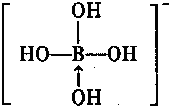 .(若存在配位键需标出)
.(若存在配位键需标出)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
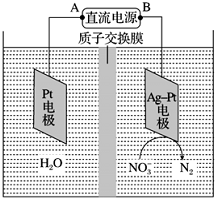 电化学降解NO3-的原理如图所示.
电化学降解NO3-的原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
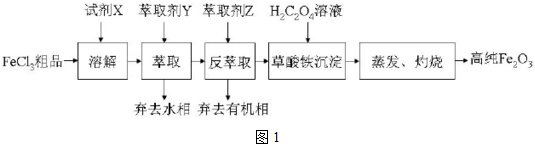
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com