
分析 依据碱金属原子结构解答:最外层电子都是1,单质在反应中容易失去最外层电子达到稳定结构,锂是碱金属元素原子半径最小的元素;
依据卤族元素原子结构解答:最外层有7个电子,在反应中容易得到1个电子达到稳定结构,F得电子能力最强,在卤族元素中非金属性最强.
解答 解:①碱金属元素原子最外层电子数都是1个,在化学反应中它们容易失去1个电子,碱金属元素原子半径最小的元素是 Li;
②卤素原子最外层的电子数都是7,在化学反应中它们容易得到1个电子,在卤族元素中非金属性最强的是 F;
故答案为:①1 1 Li ②7 1 F.
点评 本题考查了原子结构与元素性质,熟悉碱金属、卤族元素原子结构特点是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质参加或有单质生成的反应一定是氧化还原反应 | |
| B. | 氧化还原的本质是元素化合价的升降 | |
| C. | 失电子越多,该物质的还原性就越强 | |
| D. | 金属单质在化学反应中一定作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 mL容量瓶,58.5 gNaCl | B. | 500 mL容量瓶,117 g NaCl | ||
| C. | 1 000 mL容量瓶,58.5 g NaCl | D. | 1 000 mL容量瓶,117 g NaC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
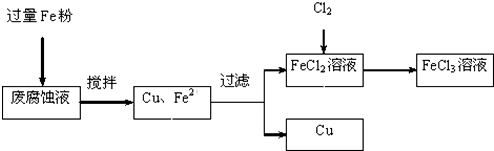
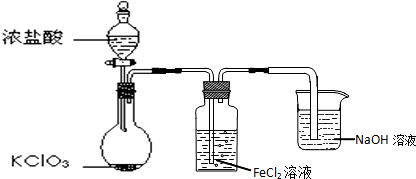
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(1)的△H大于△H1 | |
| B. | 等物质的量的甲烷分别发生①②反应至完全,转移的电子数不同 | |
| C. | 若用0.2 mol CH4发生上述反应还原足量的NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 LCH4还原足量的NO2至N2,整个过程中转移的电子的物质的量为16 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com