
【题目】实验室配制500mL0.1mol/LNa2CO3溶液回答下列问题
(1)应用托盘天平称取十水碳酸钠晶体_______g
(2)若在称量样品时,药品放在天平右盘上,磕码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是______g(1g以下用游码)
(3)用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号为_________(同一步骤可用多次)
A、调整零点 B、将游码移至刻度尺的零刻度处
C、将碳酸钠晶体放入小烧杯中称量 D、称量空的小烧杯
E、将砝码放回砝码盒内 F、记录称量结果.
(4)配制Na2CO3溶液时需用的主要仪器有____________________
(5)若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A、加水时越过刻度线_________ B、忘记将洗涤液加入容量瓶__________
C、容量瓶内壁附有水珠而未干燥处理______ D、溶解后没有冷却便进行定容_____
【答案】14.3 13.7 BADFCFEB 烧杯、天平、玻璃棒、500mL容量瓶、胶头滴管、药匙 偏低 偏低 不变 偏高
【解析】
(1)根据m=nM计算Na2CO310H2O的质量;
(2)称量样品时,若是用到游码时,物质放在左盘,称量物质量=砝码质量+游码质量;
(3)根据用托盘天平称量物质的操作要求和步骤进行分析;
(4)溶液配制操作步骤有:称量、溶解、移液、洗涤、定容、摇匀等操作,据此进行分析;
(5)根据c=![]() 进行实验误差分析。
进行实验误差分析。
(1)实验室配制500mL0.1mol/LNa2CO3溶液需要Na2CO310H2O的质量为:0.5L×0.1mol/L×286g/mol=14.3g;
(2)称量样品时,药品放在天平右盘上,砝码放在天平左盘上,则实际称量的碳酸钠晶体是14g-0.3g=13.7g;
(3)用天平称量物体时的正确操作步骤是:先将游码移至刻度尺的零刻度处并调零点,然后先称量空的小烧杯的质量,记录称量的结果,将碳酸钠晶体放入小烧杯中称量,记录称量的结果,将砝码放回砝码盒内,最后将游码移至刻度尺的零刻度处,故答案为:BADFCFEB;
(4)溶液配制操作步骤有:称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取药品,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤并将该洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所需要的仪器为:烧杯、天平、玻璃棒、500mL容量瓶、胶头滴管、药匙;
(5)A.定容时加水时超过刻度线,溶液体积偏大,配制浓度偏低;
B.洗涤液未移入容量瓶,会造成溶质损失,使配制溶液浓度偏低;
C.容量瓶内壁附有水珠而未干燥,对溶质和溶剂都无影响,所以配制浓度不变;
D.根据热胀冷缩原理可知,溶液未冷却时转入容量瓶,待溶液冷却后,溶液体积减小,浓度偏高;


科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. CCl4和SiCl4的熔点
B. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
C. I2在水中的溶解度和I2在CCl4溶液中的溶解度
D. H2SO3和H2SO4的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质与沸水缓慢反应,且该单质可制造照明弹;f为固体单质。下列有关说法正确的是

A. 简单离子的半径:Y>Z>X B. 元素的非金属性:W>X
C. 最高价氧化物对应水化物的碱性:Y>Z D. X、Y两种元素组成的化合物只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
![]()
下列说法中不正确的是( )
A. 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B. 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把4.48L CO2通过一定量的固体过氧化钠后收集到3. 36L气体(气体的测量均在标准状况下),则这3. 36L气体的质量是( )
A.6. 0gB.5. 6gC.4. 8gD.3. 8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧钴金属片中的钴有+2价和+3价,还含有锰、铁、钙、镁、铝等金属元素及碳粉等,回收钴的工艺流程如下:
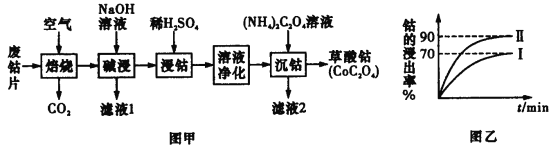
(1)焙烧时为了使废旧钴金属片充分反应,可采取的措施是____________________(任写一条)。
(2)该流程中浸钴时,钴的浸出率最高只能达到70%,后来改进方法,加入使用硫酸进行第一次浸取后,再加入Na2SO3溶液进行第二次浸取,从而使钴的浸出率达90%以上,写出第二次浸出钴时溶液中发生反应的离子方程式:____________________。
(3)净化溶液的操作中含有多个步骤,先除铁后除锰。
①除铁:常温下,调节溶液pH为1.5~2.0后,加H2O2,反应一段时间,加8%Na2CO3溶液,将溶液的pH调至4.0~5.0。已知Fe(OH)3的溶度积常数为4×10-38,则当溶液的pH调至4.0时,溶液中的c(Fe3+)=__________mol·L-1。
②除锰:加入NaClO溶液。写出该离子方程式:____________________。
③减钙镁:加入NH4F溶液,沉淀大部分的钙、镁的离子。

试解释为何草酸铵溶液沉钴前要减钙镁:______________________________。
(4)滤液2的主要成分为____________________(以化学式表示)。
(5)得到的草酸钴沉淀须洗涤干燥。写出检验沉淀已被洗净的操作与现象__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案或实验结论不正确的是( )

A.图Ⅰ结论,元素非金属性:C>Si
B.图Ⅱ结论,氧化性:Cl2>Fe3+
C.图Ⅲ结论,溶液pH:Na2CO3>NaHCO3
D.图Ⅳ结论,酸性:H2SO4>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(1)HX + CH3-CH=CH2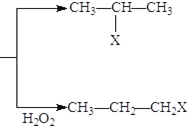 (X为卤素原子)
(X为卤素原子)
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。工业上利用上述信息,按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。
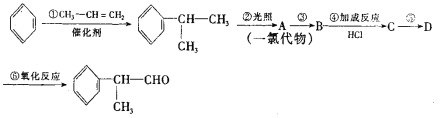
请根据上述路线,回答下列问题:
(1)A的结构简式可能为_________。
(2)反应①、③、⑤的反应类型分别为________、________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):____。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是______。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1∶2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
(1)元素X的最高价氧化物的电子式为________;元素Z的离子结构示意图为________。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为_______________________________________________________。
(3)元素W位于周期表的第________族,其非金属性比R弱,用原子结构的知识解释原因:_____________________________________________________________。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的离子方程式:__________________________________。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1∶3,则该反应的化学方程式为______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com