


| 1000ρw |
| M |
| n |
| V |
| 1000×1.84×98% |
| 98 |


科目:高中化学 来源: 题型:
| A、在任何化学反应中,只要提高反应温度,就可提高反应速率 |
| B、在任何化学反应中,只要增大某一反应物的用量,就会增大反应速率 |
| C、在任何化学反应中,增大压强时,都会使反应速率增大 |
| D、在任何化学反应中,只要缩小容器的体积,都会使反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CO2的电子式: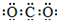 | ||
B、核内有8个中子的碳原子:
| ||
C、F-离子结构示意图: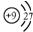 | ||
| D、HCN分子的结构式:H-C≡N |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 实验操作 | |
| A | 鉴别纯棉织品和人造纤维织品 | 用灼烧方法观察是否有烧焦羽毛气味 |
| B | 检验淀粉水解产物的还原性 | 取少量淀粉溶液,与稀硫酸共热后再加入银氨溶液,水浴加热,观察是否出现银镜 |
| C | 除去乙酸乙酯中混有的少量乙酸 | 加入足量饱和Na2CO3溶液,振荡,静置,分液,取出上层液体 |
| D | 检验氯仿中的氯元素 | 取少量氯仿加入硝酸银溶液,观察是否出现白色沉淀 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
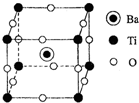 钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程.
钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程.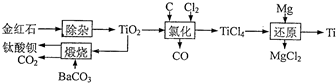
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com