
某温度下,将4mol N2与8 mol H2的混合气体通入一个1L的密闭容器中,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g),达平衡时NH3的浓度为4mol/L。请回答下列问题:
2NH3(g),达平衡时NH3的浓度为4mol/L。请回答下列问题:
⑴计算该温度下的平衡常数K;
⑵计算该条件下N2的转化率;
⑶如起始时N2的物质的量为8mol,其它条件不变,则N2的转化率__________;H2的转化率__________(上述两空选填“增大”、“减小”或“不变”)。
科目:高中化学 来源: 题型:
 2NH3(g),达平衡时NH3的浓度为4mol/L.请回答下列问题:
2NH3(g),达平衡时NH3的浓度为4mol/L.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.
(2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,将4mol N2与8 mol H2的混合气体通入一个1L的密闭容器中,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g),达平衡时NH3的浓度为4mol/L。请回答下列问题:
2NH3(g),达平衡时NH3的浓度为4mol/L。请回答下列问题:
⑴计算该温度下的平衡常数K;
⑵计算该条件下N2的转化率;
⑶如起始时N2的物质的量为8mol,其它条件不变,则N2的转化率__________;H2的转化率__________(上述两空选填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(15分)能源短缺是人类面临的重大问题。甲醇是一种可再生能源.具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
①2CH3OH(I)十3O2(g) 2CO2(g)+4H2O(g) △H= _1275.6 kJ·mol—1
②H2O(I) === H2O(g) △H=+ 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 (2分).
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1
反应B:CO(g)+2H2(g)CH3OH(g) △H2
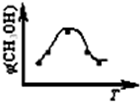
取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如下图所示,则上述CO2转化为甲醇的反应的△H1________0(填“>”、“<”或“=”)。(2分)
②对于反应A,若容器容积不变,下列措施可增加甲醇产率的是 (2分)。
A.升高温度 B.增加CO2的量
C.充入He,使体系总压强增大 D.按原比例再充入CO2和H2
③某温度下,将4mol CO和12mol H2,充人2L的密闭容器中,充分反应,达到平衡后,测得c(CO) =0.5 mol·L—1,,则该温度下该反应的平衡常数为 (2分)。
④.某种甲醇—空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液。其工作时负极的电极反应式可表示为______________________ (2分)
(3)对燃煤烟气中的SO2、NO2设物质的量之比为1∶1,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。,则该反应的化学方程式为________ 。(3分)(4)在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则
溶液中c(Na+)+c(H+)_____ c(NO3-)+c(OH-)(填写“>”“=”或“<”)(2分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com