

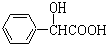 .C与乙醇发生酯化反应生成D为
.C与乙醇发生酯化反应生成D为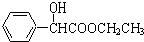 ,D中羟基被Cl原子取代生成E,E与乙二胺脱去1分子HCl、乙醇得到F,据此解答.
,D中羟基被Cl原子取代生成E,E与乙二胺脱去1分子HCl、乙醇得到F,据此解答.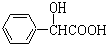 .C与乙醇发生酯化反应生成D为
.C与乙醇发生酯化反应生成D为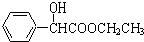 ,D中羟基被Cl原子取代生成E,E与乙二胺脱去1分子HCl、乙醇得到F.
,D中羟基被Cl原子取代生成E,E与乙二胺脱去1分子HCl、乙醇得到F.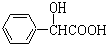 ,含氧官能团名称是:羧基、羟基,故答案为:羧基、羟基;
,含氧官能团名称是:羧基、羟基,故答案为:羧基、羟基; ,
, ;
;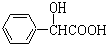 )的同分异构体:
)的同分异构体: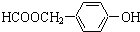 ,
,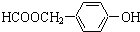 ;
;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol NO的质量是30g |
| B、标准状况下,1 mol H2O的体积是22.4 L |
| C、17 g NH3含有的氢原子总数为6.02×1023 |
| D、100 mL 0.1 mol/L Na2CO3溶液中,Na+的物质的量为 0.01 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
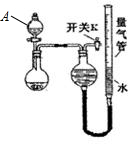
| 编号 | 粉末质量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 2.0g | 10.0mL | 346.2mL |
| ② | 2.0g | 10.0mL | 335.0mL |
| ③ | 2.0g | 10.0mL | 345.8mL |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素的第一电离能(I1)是元素的单质失去最外层1个电子所需要吸收的能量,同周期从左到右元素的I1逐渐增大 |
| B、元素的电负性是衡量元素在化合物中吸引电子能力大小的一种标度,同主族从上到下元素的电负性逐渐减小 |
| C、含有阴离子的晶体中一定含有阳离子,含有阳离子的晶体中不一定含有阴离子 |
| D、原子晶体中一定含有共价键;离子晶体中一定含有离子键,可能含有共价键;分子晶体中一定存在分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图中“过量的金属”可以是Na、Mg或Fe |
| B、反应开始时的速率:v(H2SO4)>v(HCl)>v(HAc) |
| C、最终得到氢气的体积:V H2SO4(H2)=VHCl(H2)=VHAc(H2) |
| D、所选用量筒的规格决定于金属的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com