
分析 (1)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变;平衡移动的原理来分析解答;
(2)缩小平衡体积,平衡不移动,但是密度增大,平均摩尔质量变大;
(3)①可以看到只有三种是气体,相对分子质量分别为H2O(18),CO(28),H2(2),混合之后,混合气体的平均相对分子质量不应该大于最大的28,也不能小于最小的2,理解方法就是极限法,假设绝大多数气体是H2,只有一点点H2O和CO,平均相对分子质量将会非常接近2;
②若给平衡体系加压,参照起始投放的气体物质的平均相对分子质量(设定为$\overline{M}$1),分别给出$\overline{M}$的变化,
设反应平衡时候(加压之前)H2O为a mol,CO为b mol,H2为c mol 加压以后,平衡要向逆反应方向移动,设反应了x mol(x应该小于b,c中最小的那个)
达到新平衡后,三种物质的物质量为a+x b-x c-x 摩尔
根据平均相对分子质量的计算公式M1$\frac{18a+28b+2c}{a+b+c}$,M=$\frac{18(a+x)+28(b-x)+2(c-x)}{a+x+b-x+c-x}$=$\frac{18a+28b+2c-12x}{a+b+c-x}$
很容易得到18a+28b+2c=M1(a+b+c)
消去18a+28b+2c,得M=$\frac{{M}_{1}(a+b+c)-12x}{a+b+c-x}$=$\frac{(a+b+c-x){M}_{1}+{M}_{1}x-12x}{a+b+c-x}$=M1+$\frac{({M}_{1}-12)x}{a+b+c-x}$
然后观察这个式子,进行讨论即可.
解答 解:(1)A.体系的压强一直不发生变化,故A错误;
B.v正(CO)=v正(H2O)=v逆(H2O),故B正确;
C.生成n molCO的同时生成n mol H2,未体现正与逆的关系,故C错误;
D.1mol H-H键断裂等效于,形成2mol H-O键,同时断裂2mol H-O键,故D正确;故选:BD,
故答案为:BD;
(2)若上述化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小体积),C(s)+H2O(g)?CO(g)+H2(g),则加压化学平衡逆向进行,气体质量减小,气体物质的量减小,但气体物质的量减少的多,所以容器内气体的平均相对分子质量将变大,
故答案为:变大;
(3)①可以看到只有三种是气体,相对分子质量分别为H2O(18),CO(28),H2(2),混合之后,混合气体的平均相对分子质量不应该大于最大的28,也不能小于最小的2,混合气体中当相对分子质量最小的氢气的实际质量无限大时,其他的反应物无限小就可以忽略不计了,但还是有的,相对分子质量是大于2而不是大于等于2,同理最大的相对分子质量最大的是小于28,2<$\overline{M}$<28,故答案为:2<$\overline{M}$<28;
②若给平衡体系加压,参照起始投放的气体物质的平均相对分子质量(设定为$\overline{M}$1),分别给出$\overline{M}$的变化,
设反应平衡时候(加压之前)H2O为a mol,CO为b mol,H2为c mol加压以后,平衡要向逆反应方向移动,设反应了x mol(x应该小于b,c中最小的那个)
达到新平衡后,三种物质的物质量为a+x b-x c-x 摩尔
根据平均相对分子质量的计算公式M1$\frac{18a+28b+2c}{a+b+c}$,M=$\frac{18(a+x)+28(b-x)+2(c-x)}{a+x+b-x+c-x}$=$\frac{18a+28b+2c-12x}{a+b+c-x}$
很容易得到18a+28b+2c=M1(a+b+c)
消去18a+28b+2c,得M=$\frac{{M}_{1}(a+b+c)-12x}{a+b+c-x}$=$\frac{(a+b+c-x){M}_{1}+{M}_{1}x-12x}{a+b+c-x}$=M1+$\frac{({M}_{1}-12)x}{a+b+c-x}$
然后观察这个式子,进行讨论即可.
当M1<12时,后面的分式为负,平均相对分子质量变小
当M1=12时,M=M1,平均相对分子质量不变
当M1>12时,后面的分式为正,平均相对分子质量变大
当$\overline{M}$1<12时,$\overline{M}$减小;当$\overline{M}$1=12时,$\overline{M}$不变;当$\overline{M}$1>12时,$\overline{M}$增大.
故答案为:当$\overline{M}$1<12时,$\overline{M}$减小;当$\overline{M}$1=12时,$\overline{M}$不变;当$\overline{M}$1>12时,$\overline{M}$增大.
点评 本题考查了化学平衡状态的判断和化学平衡的移动,题目难度中等,注意当反应达到平衡状态时,正逆反应速率相等,但不为0,平均相对分子质量随平衡变化的特征分析判断,掌握基础是解题关键.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 硬脂酸甘油酯在NaOH溶液中水解完全后,加入饱和食盐水,下层析出硬脂酸钠 | |
| B. | 天然高分子化合物淀粉或纤维素最终的水解产物都是葡萄糖 | |
| C. | 鸡蛋清的溶液中加入福尔马林溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
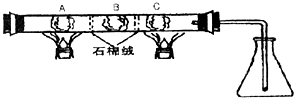 在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.
在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该烃是苯的同系物 | |
| B. | 该烃分子中至少有9个碳处于同一平面上 | |
| C. | 该烃分子中的所有原子有可能处于同一平面上 | |
| D. | 该烃的一氯代物最多有四种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和H2SO4 | B. | AlC13和NaOH | C. | NaAlO2和H2SO4 | D. | NaHCO3和Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向次氯酸钙溶液通过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 向Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+CO32-+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+=3I2+3H2O | |
| D. | 氢氧化钡溶液中加入硫酸:Ba2++OH-+H++SO42-═BaSO4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
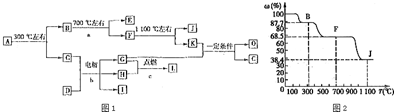
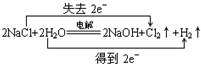
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 二氧化碳与石灰水:CO2+OH-=HCO3- | |
| B. | 氯化铁和硫氢化钠:2Fe3++2HS-=Fe2++2H++FeS↓+S↓ | |
| C. | 硫酸亚铁铵和氢氧化钡:2NH4++2OH-+Ba2++SO42-=2NH3•H2O+BaSO4↓ | |
| D. | 在酸性条件下亚硫酸钠和硫化钠:2SO32-+2S2-+8H+=3S↓+SO2↑+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com