
【题目】A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应。
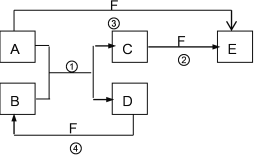
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,反应①的化学方程式是______________________。
(2)若A是常见的过渡元素金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是____________________;
(3)若B、C、F都是气态单质,且B为黄绿色,有毒,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则C的结构式是_________________,反应③的化学方程式是__________________。
(4)若A、D为短周期元素组成的单质,且元素A的原子序数是D的2倍,最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,则反应①的化学方程式是______________________。则反应④的化学方程式是__________________。
【答案】 SiO2+2C![]() Si + 2CO↑ 2Fe2++Cl2 = 2Fe3++2Cl-.
Si + 2CO↑ 2Fe2++Cl2 = 2Fe3++2Cl-. ![]() 4NH3+5O2
4NH3+5O2![]() 4NO+6H2O 2Mg + CO2
4NO+6H2O 2Mg + CO2![]() 2MgO + C C + 4HNO3
2MgO + C C + 4HNO3![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
【解析】(1)A+B=C+D是置换反应,AD为同主族,判断为A为C,B为SiO2,A、F所含元素同周期,C+F=E,A+F=E,D+F=B,判断F为O2;反应①的化学方程式为SiO2+2C![]() Si + 2CO↑;
Si + 2CO↑;
(2)A+B=C+D是置换反应,A为金属,D、F是气态单质,反应①在水溶液中进行,C+F=E,A+F=E,D+F=B说明A元素具有变价,判断A为Fe,B为HCl,C为FeCl2,F为Cl2;反应②(在水溶液中进行)的离子方程式是:2Fe+Cl2=2Fe3+;
(3)A+B=C+D是置换反应,B、C、F都是气态单质,且B有毒判断为Cl2;A、D相遇有白烟生成,A为 NH3,D为HCl,白烟为氯化铵;反应②需要放电才能发生判断C为N2,F为O2,E为NO;上述推断符合③和④两个反应中都有水生成;则C的结构式是![]() ;反应③的化学方程式为4NH3+5O2
;反应③的化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(4)A+B=C+D是置换反应,若A、D为短周期元素单质,且A为固体金属单质,D为固体非金属单质,③和④两个反应中都有红棕色气体生成,非金属单质D为C,F为浓硝酸,金属置换非金属单质的反应应为镁和二氧化碳反应生成氧化镁和碳的反应,判断A为Mg;B为CO2;C为MgO;D为C;E为Mg(NO3)2;F为NHO3;则反应①的化学方程式是2Mg + CO2![]() 2MgO + C;则反应④的化学方程式是C + 4HNO3
2MgO + C;则反应④的化学方程式是C + 4HNO3![]() CO2↑+4NO2↑+2H2O。
CO2↑+4NO2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s) ![]() CuSO4(s)+5H2O(l),热效应为ΔH3,则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为ΔH3,则下列判断正确的是( )
A.ΔH2>ΔH3 B.ΔH1<ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的叙述正确的是( )
A.元素周期表中有18列,即18个族
B.目前使用的元素周期表中,最长的周期含有32种元素
C.短周期元素是指1~20号元素
D.原子的种类和元素的种类一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,已知0.1mol﹒L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8。
① 常温下,0.1 mol﹒L-1 HA溶液的pH=_________;设计一个简单实验证明HA是强酸还是弱酸_________。
② pH=3的HA与pH= 11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:______________。
(2)常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH______________14—a (>、<、=)
(3)向物质的量浓度均为0.01 mol﹒L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是______________,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+) 。
(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)
(4)己知常温下CH3COOH的电离平衡常数为1.7×10-5,则该温度下CH3COO-的水解平衡常数等于____________(保留小数点后两位数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质或应用均正确的是
A.二氧化硅为酸性氧化物,可用于制做计算机芯片
B.铜的金属活泼性比铁差,可在海轮外壳上装若干铜块以减缓其腐蚀
C.Zn具有还原性和导电性,可用作锌锰干电池的负极材料
D.浓硫酸具有脱水性,可用于干燥NH3、SO2等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应中属于放热反应的是
A. 氢氧化钾与硝酸反应 B. 焦炭在高温下与水蒸气反应
C. 石灰石分解成氧化钙和二氧化碳 D. Ba(OH)2·8H2O与NH4Cl的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015海南卷】氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2, 其△H= kJ·mol-1。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com