
分析 过程A中Fe元素的化合价升高,过程B中Fe元素的化合价降低,Vitc使Fe3+转化为Fe2+,Fe元素的化合价降低,则Vitc在这一过程中某元素的化合价升高.氧化剂化合价降低,具有氧化性;还原剂化合价升高,具有还原性.
解答 解:过程A中Fe元素的化合价升高,则Fe2+做还原剂;过程B中Fe元素的化合价降低,则Fe3+作氧化剂,被还原,Vitc使Fe3+转化为Fe2+,Fe元素的化合价降低,则Vitc在这一过程中某元素的化合价升高,则作还原剂,具有还原性,
故答案为:D; B; C.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和应用能力的考查,明确反应中元素的化合价变化是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
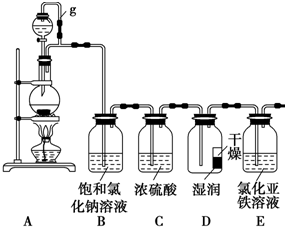 某探究小组为探究氯气的性质,设计了如下实验装置.请回答下列问题:
某探究小组为探究氯气的性质,设计了如下实验装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格 | 除容量瓶、小烧杯、玻璃棒、胶头滴管外还需要的其它玻璃仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.10mol•L-1CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-) | |
| B. | 向0.10mol•L-1NH4HCO3溶液中通CO2:c(NH4+)═c(HCO3-)+c(CO32-) | |
| C. | 向0.10mol•L-1NaHSO3溶液中通NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| D. | 向0.10mol•L-1 Na2SO3溶液中通SO2:c(Na+)═2[c(HSO3-)+c(SO32-)+c(H2SO3)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学欲配制4mol•L-l的硫酸,但实验室只有三种不同浓度的硫酸:
某同学欲配制4mol•L-l的硫酸,但实验室只有三种不同浓度的硫酸:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,氧元素在周期中的位置是第二周期第VIA族.
,氧元素在周期中的位置是第二周期第VIA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 道尔顿提出原子学说 | |
| B. | 门捷列夫提出了元素周期律 | |
| C. | 汤姆生发现电子,并提出原子结构轨道模型 | |
| D. | 舍勒发现了氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com