
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 124 g P4含有P—P键的个数为4NA B. 12 g石墨中含有C—C键的个数为1.5NA
C. 12 g金刚石中含有C—C键的个数为4NA D. 60gSiO2中含Si—O键的个数为2NA
【答案】B
【解析】A、n(P4)=![]() =
=![]() =1mol,1个P4分子含有6个P-P键,因此124g P4含有的P-P键的物质的量为6mol,P-P键的个数为6NA,选项A错误;B.12g石墨中含有碳原子个数=
=1mol,1个P4分子含有6个P-P键,因此124g P4含有的P-P键的物质的量为6mol,P-P键的个数为6NA,选项A错误;B.12g石墨中含有碳原子个数=![]() ×NA/mol=NA,石墨中每个碳原子含有
×NA/mol=NA,石墨中每个碳原子含有![]() 个C-C键,所以12g石墨中含有C-C键个数是1.5NA,选项B正确;C.12g金刚石中含有碳原子个数=
个C-C键,所以12g石墨中含有C-C键个数是1.5NA,选项B正确;C.12g金刚石中含有碳原子个数=![]() ×NA/mol=NA,金刚石中每个碳原子含有2个C-C键,所以12g金刚石中含有C-C键个数是2NA,选项C错误;D.60g二氧化硅中含有的硅原子个数=
×NA/mol=NA,金刚石中每个碳原子含有2个C-C键,所以12g金刚石中含有C-C键个数是2NA,选项C错误;D.60g二氧化硅中含有的硅原子个数=![]() ×NA/mol=NA,每个硅原子含有4个Si-O键,所以60g二氧化硅中含有的Si-O键的个数为4NA,选项D错误;答案选B。
×NA/mol=NA,每个硅原子含有4个Si-O键,所以60g二氧化硅中含有的Si-O键的个数为4NA,选项D错误;答案选B。


科目:高中化学 来源: 题型:
【题目】实验室制备1-溴丁烷的原理为CH3CH2CH2CH2OH+NaBr+H2SO4![]() CH3CH2CH2CH2Br+NaHSO4+H2O,根据原理设计实验装置如图1所示(夹持装置已略去)
CH3CH2CH2CH2Br+NaHSO4+H2O,根据原理设计实验装置如图1所示(夹持装置已略去)
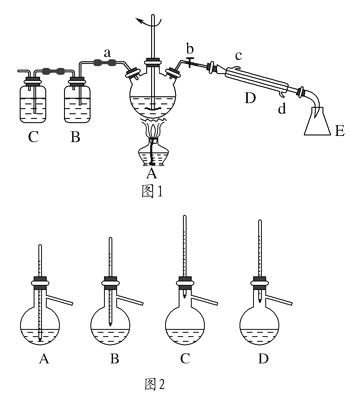
(1)仪器D的名称为________,使用玻璃棒搅拌的目的是__________________。
(2)1-溴丁烷的制备反应中可能有:________、________、溴化氢等副产物生成。熄灭图1中A装置中的酒精灯,打开a,余热会使反应继续进行。B、C装置可检验部分副产物,则B、C装置中所盛放的试剂分别是________、________。
(3)为了精制1-溴丁烷,待烧瓶冷却后,将A装置中的玻璃棒换成温度计,关闭a,打开b,使冷水从________(填“c”或“d”)处流入。对粗产品进行蒸馏提纯时,图2装置中温度计的位置正确的是________(填字母,下同),可能会导致收集到的产品中混有低沸点杂质的装置是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过电解精制饱和食盐水来制备NaOH、H2、Cl2,再合成盐酸。完成下列填空:
(1)粗盐提纯:为除去粗盐中的Ca2+、Mg2+、SO42—。向粗盐溶液中依次加入稍过量的NaOH溶液、______,过滤后,再向滤液中加入适量__________,再蒸发。
(2)电解饱和食盐水:25℃,电解10L饱和食盐水,若阴极收集到标准状况下11.2L_______(填气体化学式),则溶液pH=_______(设溶液体积、温度不变、忽略生成物间的反应)。
(3)工业制盐酸:利用Cl2和H2化合,所得产物再溶于水的方法制得盐酸,生产流程如下:

为确保Cl2完全反应,合成塔中n(H2)略大于n(Cl2)。写出一条Cl2必须反应完全的理由:______。
(4)盐酸浓度测定:可用滴定法,用盐酸滴定已知质量Na2CO3的溶液。过程如下:准确称量一定质量的Na2CO3固体于锥形瓶中,加蒸馏水使其溶解,滴加指示剂X,用待测盐酸滴定,接近终点时,加热锥形瓶,煮沸液体2min,冷却至室温,继续滴定至终点,记录消耗盐酸的体积。重复上述过程三次,计算盐酸浓度。
已知:指示剂X的变色范围是5.0~5.2; 25℃,饱和CO2水溶液pH≈4。
①本测定用的仪器有锥形瓶、烧杯、玻璃棒、____________________________________。
②本测定的反应原理是________________________________(用化学方程式表示)。
③接近终点时煮沸反应混合物的目的是_______________________________。
④盛放Na2CO3固体的锥形瓶不干燥,对实验结果的影响是_________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料——赤泥中提取金属钒,具体工艺流程图如下:
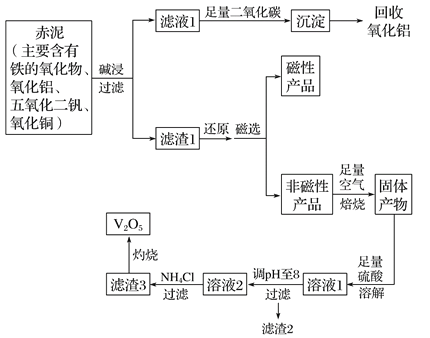
已知:
I.钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡
VO2++H2O![]() VO3-+2H+。
VO3-+2H+。
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
物质 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 易溶 |
Ⅲ.部分离子的沉淀pH值:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
请回答下列问题:
(1)碱浸步骤中最好选用 。
A.NaOH溶液 B.氨水 C.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式 。
(3)磁选步骤得到的磁性产品为 。
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使 。
(5)滤渣3的主要成分为 ,工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在加热条件下,用二氧化锰与足量浓盐酸反应,制得氯气0.56L(标准状况)。问:
(1)理论上需要消耗MnO2的质量为__________。
(2)被氧化的HCl的物质的量是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 大气污染问题日益引起全民关注.
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物.下列说法不正确的是______(填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)某地科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2
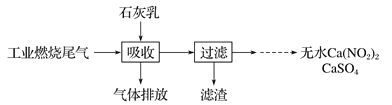
硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为___________、__________.
CaSO4可以调节水泥的硬化时间.尾气中2molSO2被石灰乳逐渐吸收最终生成了1molCaSO4,该过程中转移的电子数目为___________。
③Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式_________________.
(3)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
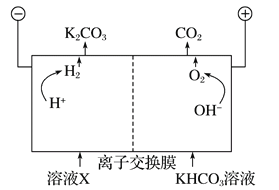
在阳极区发生的反应包括___________和H++HCO3-=H2O+CO2↑。
简述CO32-在阴极区再生的原理___________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25℃,101KPa下:
H2(g)+![]() O2(g)═H2O(g)△H1=-242kJ/mol
O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+![]() O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应2X(g)+Y2(g)![]() 2XY(g) ΔH <0,达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是
2XY(g) ΔH <0,达到甲平衡。在仅改变某一条件后,达到乙平衡,下列分析正确的是
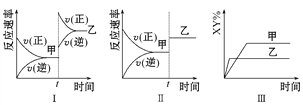
A. 图Ⅰ中,甲、乙的平衡常数分别为K1、K2,则K1<K2
B. 图Ⅱ中,t时间是增大了压强
C. 图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低
D. 图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。经过5 min后,反应达到平衡,此时H2的转化率为60%。
CH3OH(g)。经过5 min后,反应达到平衡,此时H2的转化率为60%。
(1)该反应的平衡常数为________,v(CH3OH)=________mol·L-1·min-1。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时v(正)________v(逆)(填“>”“<”或“=”)。
(2)在一定压强下,容积为VL的容器充入amol CO与2amol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。则ΔH___0,p1____p2(填“大于”“小于”或“等于”)。
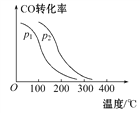
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出CH3OH气体 b.适当升高温度 c.增大H2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性。充电时右槽溶液颜色由绿色变为紫色。下列叙述正确的是

A. 放电时,H+从左槽迁移进右槽
B. 放电过程中,左槽溶液颜色由黄色变为蓝色
C. 充电时,b极接直流电源正极,a极接直流电源负极
D. 充电过程中,a极的电极反应式为:VO2++2H++e- = VO2++H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com