
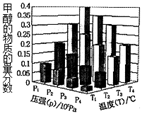
 反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )
反应3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,在一定条件下达到平衡时,改变温度(T)和压强(P),CH3OH物质的量分数的变化情况如图所示,下列判断正确的是( )| A. | P3>P2 T3>T2 | B. | P2>P4 T4>T2 | C. | P1>P3 T1>T3 | D. | P1>P4 T2<T3 |
分析 根据平衡移动原理:增大压强,平衡向体积缩小的方向移动,温度升高,平衡向着吸热方向进行.在一定温度和压强条件下发生了反应:3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,增大压强,平衡正向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐增大,温度升高,平衡逆向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐减小,结合图象判断甲醇的物质的量分数变化情况判断.
解答 解:增大压强,平衡向体积缩小的方向移动,在一定温度和压强条件下发生了反应:3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,增大压强,平衡正向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐增大,即P1>P2>P3>P4,
温度升高,平衡向着吸热方向进行,在一定温度和压强条件下发生了反应:3H2(g)+CO2(g)?CH3OH(g)+H2O (g)△H<0,温度升高,平衡逆向移动,则反应混合物中甲醇(CH3OH)的物质的量分数逐渐减小,故T1>T2>T3>T4,
故选C.
点评 本题考查化学平衡的影响因素以及化学平衡的计算知识,属于综合知识的考查,注意根据平衡移动原理分析解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验及现象 | 能量关系 |
| A | 将盛“NO2玻璃球”置热水中,红棕色加深 | N2O4(g)?2NO2(g) △H<0 |
| B | NaOH与HCl溶液混合,溶液温度升高 | 反应物的能量>生成物的能量 |
| C | 钠投入水中,熔化成小球 | 反应物的能量<生成物的能量 |
| D | 微热含酚酞的Na2CO3溶液,溶液红色加深 | CO32-+H2O?HCO3-+OH-△H<0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释2倍后,两溶液的pH均减小 | |
| B. | 使温度都升高20℃后,两溶液的pH均不变 | |
| C. | 加适量的醋酸钠晶体后,盐酸pH增大,醋酸pH不变 | |
| D. | 加足量的锌充分反应后,醋酸产生的氢气比盐酸多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液显酸性是因为:HSO3-+H2O?SO32-+H3O+ | |
| B. | 尼泊金酸(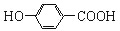 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: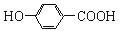 +2HCO3-→ +2HCO3-→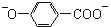 +CO2↑+2H2O +CO2↑+2H2O | |
| C. | KAl(SO4)2溶液中加入少量氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ | |
| D. | 足量硫酸氢钠溶液与氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 其中含有的化学键的类型离子键、共价键
其中含有的化学键的类型离子键、共价键查看答案和解析>>
科目:高中化学 来源: 题型:选择题
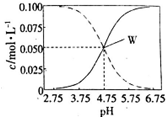 室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关叙述正确的是( )
室温条件下在醋酸、醋酸钠混合溶液中,当c(CH3COOH)+c(CH3COO-)=0.lmol.L-1时,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关叙述正确的是( )| A. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 向W点所表示的1.0L溶液中通人0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) | |
| C. | W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH)- | |
| D. | pH=3.5的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol.L-l |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
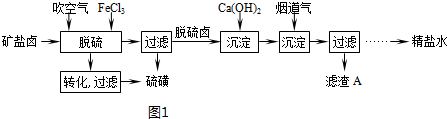
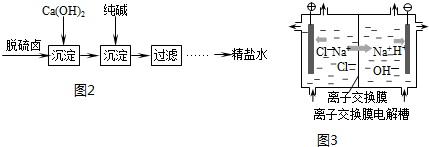
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com