
| A、①④⑤ | B、④⑤ |
| C、④⑤⑦ | D、③④⑤ |


科目:高中化学 来源: 题型:
| A、市场上假酒销售时有发生,假酒的有毒成分主要是甲醇 |
| B、由石油分馏可获得汽油、煤油、柴油等,可用作燃料和煤油还可保存少量金属钠 |
| C、甲醛水溶液可以用来作食品防腐剂 |
| D、遵守《保护臭氧层维也纳公约》,限制生产和销售氟里昂可减少对大气臭氧层的破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油、煤、小苏打都是混合物 |
| B、烧碱、纯碱、碱石灰都是碱 |
| C、HNO3、NaOH、NaNO3都是电解质 |
| D、HCl、H2SO4、NaOH都是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,1L pH=12的Ba(OH)2溶液中含有的OH-数为0.01NA |
| B、常温下,1L 0.1mol/L的CH3COOH溶液中含有的H+数为0.1NA |
| C、11.2 L乙烯、乙烷的混合气体中含有的碳原子数为NA |
| D、5.6 g Fe和足量盐酸完全反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Be2+中的电子数和质子数之比一定为1:2 |
| B、D216O中,质量数之和是质子数之和的两倍 |
| C、在氮原子中,质子数为7而中子数不一定为7 |
D、Cl-的结构示意图为: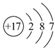 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F六种元素位于周期表前四周期且原子序数依次增大.①A元素的一种核素中子数是质子数的2倍;②基态B原子核外有两个未成对电子;③大气中C的游离态含量最高;④D原子基态核外电子运动状态共8种;⑤E、F原子序数相差3,基态E原子中有4个未成对屯子且全在同一能级内.
A、B、C、D、E、F六种元素位于周期表前四周期且原子序数依次增大.①A元素的一种核素中子数是质子数的2倍;②基态B原子核外有两个未成对电子;③大气中C的游离态含量最高;④D原子基态核外电子运动状态共8种;⑤E、F原子序数相差3,基态E原子中有4个未成对屯子且全在同一能级内.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com