
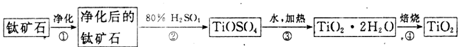
分析 (1)氧化亚铁和硫酸反应生成硫酸亚铁;
(2)二氧化硅是酸性氧化物、氧化铝是两性氧化物都和氢氧化钠溶液反应;
(3)阴极上得电子反应还原反应生成金属钛;
(4)由于电解过程中,电解槽的阳极产生氧气,碳单质会与阳极产生的氧气反应而不断减少;
(5)将方程式TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)△H=+151kJ•mol-1和C(s)+O2(g)=CO2(g);△H=-394kJ•mol-1相加,得出TiO2与Cl2、C反应制各TiCl4的热化学方程式;
(6)根据外界条件对化学平衡的影响分析,该反应是可逆反应,碳单质与氧气反应减小产物浓度使平衡向右移动,且反应中有热量放出.
解答 解:(1)氧化亚铁和硫酸反应生成硫酸亚铁,所以净化钛矿石时,不需要除去杂质FeO,
故答案为:不需要;
(2)氧化铝是两性氧化物,既能和强酸反应又能和强碱反应生成盐和水Al2O3+2NaOH=2NaAlO2+H2O,
二氧化硅是酸性氧化物,能和强碱反应生成硅酸钠和水SiO2+2NaOH=Na2SiO3+H2O,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;SiO2+2NaOH=Na2SiO3+H2O;
(3)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,电极反应式为TiO2+4e-=Ti+2O2-.
故答案为:TiO2+4e-=Ti+2O2-;
(4)由于电解过程中,电解槽的阳极产生氧气,碳单质会与阳极产生的氧气反应而不断减少,所以电解过程中需定期向电解槽池中加入炭块,
故答案为:碳单质会与阳极产生的氧气反应而不断减少;
(5)将方程式TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)△H=+151kJ•mol-1和C(s)+O2(g)=CO2(g)△H=-394kJ•mol-1相加,
得方程式:TiO2(s)+2Cl2(g)+C(s)=TiCl4(l)+CO2(g)△H=+151kJ•mol-1-394kJ•mol-1=-243KJ•mol-1,
故答案为:-243KJ•mol-1;
(6)TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g),该反应是可逆反应,碳单质与氧气反应减小产物浓度使平衡向右移动,且反应中有热量放出,温度升高,导致反应顺利进行,
故答案为:碳单质与氧气反应减小产物浓度,使平衡向右移动,导致反应顺利进行;碳与氧气反应放热,相当于升高温度,平衡向着右移动.
点评 本题考查了热化学反应方程式、电极反应式的书写等知识点,题目难度中等,充分考查了学生的分析、理解能力,注意热化学反应方程式相加减时,反应热应相应的加减.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 19:8 | B. | 22:1 | C. | 13:8 | D. | 8:13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要参加反应的Na2O2的物质的量一定,反应生成的氧气的量就一定 | |
| B. | 只要CO2和H2O(g)的中的物质的量一定,反应所消耗的Na2O2的量就一定 | |
| C. | 只要混合气体的总的物质量一定,反应中所转移的电子的物质的量就一定 | |
| D. | 只要混合气体的总的物质的量一定,固体所增加的质量就一定 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
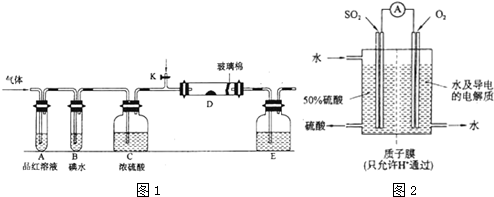
 2SO3.
2SO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a是铁,b是稀硝酸(过量)且a可溶于c溶液中.则a与b反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| B. | 若c,d为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪去,其褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br- | |
| C. | 若c是无色刺激性气味的气体,其水溶液显弱碱性,在标准状况下用排空气法收集c气体得平均摩尔质量为20 g•mol-1的混合气体进行喷泉实验.假设溶质不扩散,实验完成后所得溶液的物质的量浓度约为0.056 mol•L-1 | |
| D. | 若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5,则上述反应的离子方程式为4CO2+5OH-=CO32-+3HCO3-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
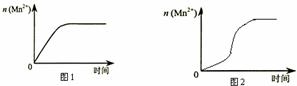 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3 mol/L 稀H2SO4 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | V1 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | V2 | ||
| 实验 编号 | 室温下,试管中所加试剂及其用量/mL | 在向试管中加 入少量固体 | 室 温 下溶液颜 色 褪 至 无 色 所 需时间/min | |||
| 0.6mol/L H2C2O4 溶液 | H2O | 0.2mol/L KMnO4 溶液 | mol/L 稀 硫酸 | |||
| 4 | 3.0 | 2.0 | 2.0 | t | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、Br2、I2的沸点逐渐升高,是因为分子间作用力越来越大 | |
| B. | NaOH和NH4Cl化学键类型相同 | |
| C. | N2和CCl4两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 石英晶体是原子晶体,其分子式为SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果设“此”为电解质,“彼”为非电解质,不是所有的物质都是非此即彼的 | |
| B. | 不是所有反应,都遵循由强(如强酸、强碱、强氧化剂或强还原剂等)制弱(如弱酸、弱碱、弱氧化剂 或弱还原剂等)的规律 | |
| C. | 不是所有自发进行的反应都一定是焓减少的过程 | |
| D. | 在迄今发现的元素中,不一定所有非金属元素(稀有气体除外)都满足条件“主族元素的族序数≥其周期序数” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com