
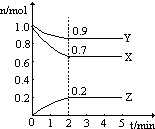
 某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线.由图中数据分析,该反应的化学方程3X+Y=2Z;反应从开始计时,
某温度时,图中曲线X,Y,Z是在2L容器中X,Y,Z三种物质的物质的量随时间的变化曲线.由图中数据分析,该反应的化学方程3X+Y=2Z;反应从开始计时,分析 根据图可知,反应从开始计时,2分钟时反应达到平衡,在达到的平衡的过程中X的物质的量减小了0.3mol,Y的物质的量减小了0.1mol,Z的物质的量增加了0.2mol,根据反应物质物质的量减小,生成物质的物质的量增大,各物质的物质的量变化量之比等于反应中计量数之比,可书写出化学方程式,根据v=$\frac{△c}{△t}$计算反应速率;
解答 解:根据图可知,反应从开始计时,2分钟时反应达到平衡,在达到的平衡的过程中X的物质的量减小了0.3mol,Y的物质的量减小了0.1mol,所以XY为反应物,Z的物质的量增加了0.2mol,Z为生成物质,根据物质的物质的量变化量之比等于反应中计量数之比,可知化学方程式为3X+Y=2Z,2分钟内X的平均反应速率为$\frac{\frac{0.3mol}{2L}}{2min}$=0.075mol/(mol•L),Y的平均反应速率为$\frac{\frac{0.1mol}{2L}}{2min}$=0.025mol/(mol•L),Z的平均反应速率为$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(mol•L),
故答案为:3X+Y=2Z;0.075mol/(mol•L)、0.025mol/(mol•L)、0.05mol/(mol•L).
点评 本题考查化学反应速率图象题目,题目难度不大,把握化学反应速率的定义和反应中物质的量变化量之比等化学计量数之比为解答的关键.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
 实验室可用如图所示装置(缺少收集装置,夹持固定装置以略去)制备并收集氨.
实验室可用如图所示装置(缺少收集装置,夹持固定装置以略去)制备并收集氨.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
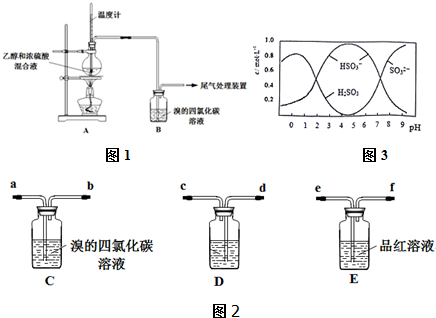
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大B的浓度,v(正)>v(逆) | |
| B. | 升高温度,平衡向逆反应方向移动,v(正)减小 | |
| C. | 压强增大一倍,平衡不移动,v (正)、v(逆)不变 | |
| D. | 增加A的量,平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com