
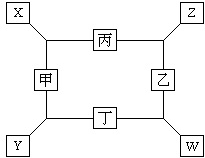
 如图所示,已知:
如图所示,已知:
| ||
| △ |
| ||
| △ |
| ||
| ||


科目:高中化学 来源: 题型:
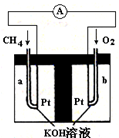 燃料电池(Fuel Cell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置.燃料和空气分别送进燃料电池,电就被奇妙地生产出来.它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”.
燃料电池(Fuel Cell)是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置.燃料和空气分别送进燃料电池,电就被奇妙地生产出来.它从外表上看有正负极和电解质等,像一个蓄电池,但实质上它不能“储电”而是一个“发电厂”.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.00molNaCl中含有NA个NaCl分子 |
| B、欲配制1.00L,1.00mol.L-1的NaCl溶液,可将58.5gNaCl溶于 1.00L水 |
| C、1.12L Cl2含有1.7NA个质子 |
| D、1molCl2与足量的铁反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
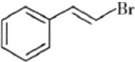 )具有强烈的类似素馨花青甜膏香,主要用于柏木,风信子,紫丁香,水仙,葵花香型皂用和洗衣粉香精中.以下是某课题组开发的从廉价、易得的化工原料出发制备E-β-溴代苏合香烯的合成路线:
)具有强烈的类似素馨花青甜膏香,主要用于柏木,风信子,紫丁香,水仙,葵花香型皂用和洗衣粉香精中.以下是某课题组开发的从廉价、易得的化工原料出发制备E-β-溴代苏合香烯的合成路线: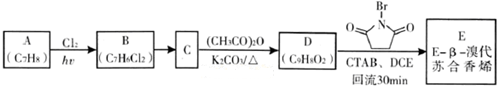
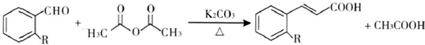
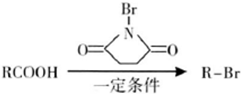
查看答案和解析>>
科目:高中化学 来源: 题型:
| 气体 | 固体反应物 | 选用的酸 | 该酸的作用 | 离子方程式 |
| CO2 | 大理石 | |||
| Cl2 | MnO2 | |||
| H2 | 锌粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铁及铁的化合物用途非常广泛.
铁及铁的化合物用途非常广泛.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:2:3 |
| B、1:1:3 |
| C、1:1:1 |
| D、3:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
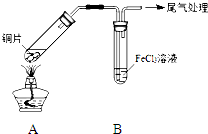 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.| 步骤① | 配制1mol?L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
| 步骤② | 往5mL 1mol?L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol?L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、剩余40mL气体一定是O2 |
| B、剩余40mL气体是H2S或SO2 |
| C、混合气体中含H2S 40mL或80mL |
| D、剩余40mL气体是SO2和O2混合气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com