
| A. | 同族元素的氧化物不可能形成不同类型的晶体 | |
| B. | SiO2晶体网状结构的最小的环上,Si和O原子数之比为1:2 | |
| C. | 满足难溶于水,熔点高,固体不导电,熔化时导电的晶体为离子晶体 | |
| D. | 同分异构体中,燃烧热数值越大,该物质越稳定 |
分析 A.同主族元素的氧化物晶体类型可能不同;
B.SiO2晶体网状结构的最小的环上含有6的氧原子和6个硅原子;
C.离子化合物的构成微粒为离子,其熔融状态下能导电,熔点高、固态不导电;
D.根据物质能量越低越稳定判断.
解答 解:A.同主族元素的氧化物晶体类型可能不同,如二氧化碳是分子晶体、二氧化硅是原子晶体,故A错误;
B.最小的环上,有6个Si原子和6个O原子,所以最小的环上硅氧原子数之比为1:1,故B错误;
C.晶体难溶于水、熔点高,固态时不导电,熔化时能导电,说明熔化时有自由移动的离子,属于离子晶体,故C正确;
D.因为同分异构体分子式相同,所以燃烧消耗的氧气和生成的产物都相同,又燃烧热数值越大,该物质具有的能量越高,则越不稳定,故D错误;
故选C.
点评 本题考查物质稳定性的判断、晶体类型的判断以及结构等知识点,明确晶体类型判断方法即可解答,难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:解答题
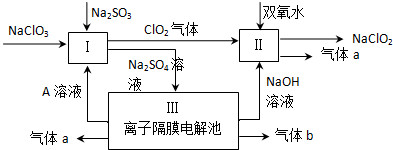
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
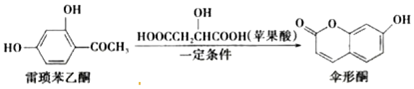
| A. | 雷琐苯乙酮有两种含氧官能团 | |
| B. | 1 mol伞形酮与足量 NaOH溶液反应,最多可消耗 2 mol NaOH | |
| C. | 伞形酮难溶于水 | |
| D. | 雷琐苯乙酮和伞形酮都能跟 FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3是钠盐 | B. | Na2CO3是含氧酸盐 | ||
| C. | Na2CO3是碳酸盐 | D. | Na2CO3是碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
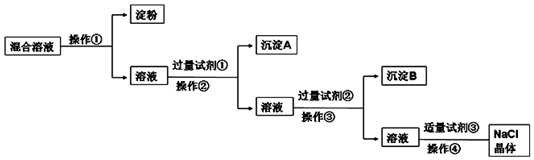
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42- 0.1 mol•L-1 | B. | Al3+ 0.2 mol•L-1 | ||
| C. | Cl- 0.3 mol•L-1 | D. | K+ 0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取KMnO4溶液12.00mL | |
| B. | 测定中和热时将NaOH溶液迅速一次性倒入盛有盐酸的小烧杯中,盖好盖板 | |
| C. | 常温下,测得0.01mol/LNaHCO3溶液的pH值=12 | |
| D. | 加热蒸发FeCl3溶液,获得FeCl3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
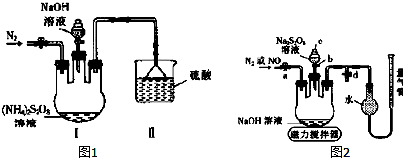
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com