
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第3周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| KW |
| c(H+) |
| A、④⑦ | B、②③④ |
| C、③⑧ | D、①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
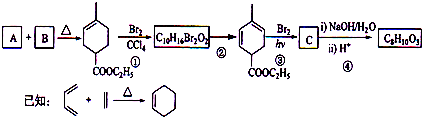
查看答案和解析>>
科目:高中化学 来源: 题型:
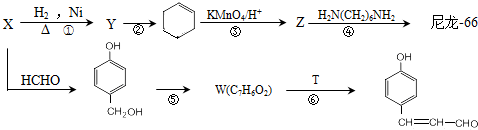
| 稀NaOH溶液 |
| H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、应量取的浓盐酸的体积是9.6mL |
| B、若开始时洁净的容量瓶中有少许蒸馏水,对实验没有影响 |
| C、量取浓盐酸时,仰视量筒将使所配溶液的浓度偏低 |
| D、定容摇匀后,发现液面低于刻度线,应立即加少量蒸馏水补齐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com