
| A. | 丙烯能发生取代反应、加成反应,还能使酸性KMnO4溶液褪色 | |
| B. | 分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种 | |
| C. | 甲苯中所有原子都处于同一平面 | |
| D. | 相同质量的甲烷和乙烷完全燃烧,乙烷耗氧量多 |
分析 A.丙烯中含有碳碳双键,能发生加成反应和使酸性高锰酸钾溶液褪色,含有H原子,能发生取代反应;
B.分子式为C7H16的烃属于烷烃,含有3个甲基,则该烷烃只有1个支链,据此根据烷烃同分异构体的书写进行判断;
C.根据常见的有机化合物中甲烷是正四面体结构,乙烯是平面型结构,其它有机物可在此基础上进行共线、共面分析判断.注意单键可以旋转;
D.等质量的烃(CXHY)在充分燃烧时,消耗O2的量取决于$\frac{Y}{X}$,$\frac{Y}{X}$越大消耗O2的量越多.
解答 解:A.丙烯属于烯烃且含有一个甲基,甲基上发生取代反应,碳碳双键能发生加成、能使高锰酸钾溶液褪色,因此符合题意,故A正确;
B.该烃结构式中含有3个甲基,则该烷烃只有1个支链,若支链为-CH3,主链含有6个碳原子,符合条件有:CH3CH(CH3)CH2CH2CH2CH3,CH3CH2CH(CH3)CH2CH2CH3;若支链为-CH2CH3,主链含有5个碳原子,符合条件有:CH3CH2CH(CH2CH3)CH2CH3;支链不可能大于3个碳原子,故符合条件的烷烃有3种,故B错误;
C.甲苯中有一个甲基,甲基具有甲烷的结构特点,因此所有原子不可能处于同一平面上,故C错误;
D.相同质量的甲烷和乙烷完全燃烧,两者的$\frac{Y}{X}$分别为4,3,所以乙烷耗氧量少,故D错误,故选A.
点评 本题主要考查了有机物的结构、性质与用途,难度不大,属于基础性知识考查.


科目:高中化学 来源: 题型:选择题
| A. | 氯化钠在电流的作用下电离出Na+和Cl- | |
| B. | CaCO3难溶于水,但CaCO3属于强电解质 | |
| C. | 二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 | |
| D. | 硫酸钠在水中的电离方程式可表示为Na2SO4═2Na++S6++4O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na和AlCl3溶液反应 | B. | 最高价氧化物对应水化物的碱性 | ||
| C. | 单质与H2O反应的难易程度 | D. | 同浓度NaCl和AlCl3溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 | |
| B. | NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(Na+)=2c(SO42-) | |
| C. | 0.1 mol•L-1CH3COOH溶液与0.1 mol•L-1CH3COONa等体积混合后pH<7,则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | KNO3和CH3COONH4溶液pH均为7,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
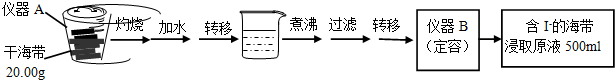
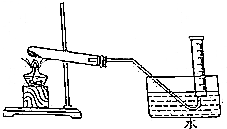 为验证MnO2在KClO3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:
为验证MnO2在KClO3受热分解制O2的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 酸性KI淀粉溶液久置后变蓝 4I-+O2+2H2O═2I2+4OH- | |
| C. | 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞SiO2+2OH-═SiO32-+H2O | |
| D. | 向次氯酸钙溶液通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com