
【题目】A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素最高价氧化物对应的水化物之间两两皆能反应。请回答下列问题:
(1)B元素的原子结构示意图是______________;D元素在周期表中的位置是第________周期________族。
(2)A、B、C和F可组成一种化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式:_______________________,_______________________________。
(3)写出E2C3分别与盐酸和氢氧化钠溶液反应的离子方程式:_______________________________ ,_________________________________。
(4)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐相互反应的离子方程式为_____________________________________________________。
(5)A、C、F间可形成甲、乙两种微粒,它们均为-1价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为_______________________________。
(6)向含有a mol E的氯化物的溶液中加入含b mol D的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为________(填序号)。
①a mol ②b mol ③a/3 mol ④b/3 mol ⑤0 ⑥(4a-b) mol
【答案】 ![]() 3 ⅠA 硫酸铵 (NH4)2SO4 Al2O3+6H+=2Al3++3H2O Al2O3+2OH-+3H2O=2[Al(OH)4]-或Al2O3+2OH-=2AlO2-+H2O H++HSO3--=H2O+SO2↑ OH-+HS-=H2O+S2- ②
3 ⅠA 硫酸铵 (NH4)2SO4 Al2O3+6H+=2Al3++3H2O Al2O3+2OH-+3H2O=2[Al(OH)4]-或Al2O3+2OH-=2AlO2-+H2O H++HSO3--=H2O+SO2↑ OH-+HS-=H2O+S2- ②
【解析】分析:A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,则A为H;B元素的最高价氧化物对应水化物与其气态氢化物能反应生成盐,则B为N;F元素原子的最外层电子数是其次外层电子数的3/4,则F为S;D与A同主族,且与F同周期,则D为Na;A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O,D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应,可知E为Al,根据元素周期律结合问题解答该题。
详解:根据以上分析可知A、B、C、D、E、F六种短周期元素分别是H、N、O、Na、Al、S。则
(1)B元素是N,原子序数是7,则原子结构示意图是![]() ;D元素是Na,原子序数是11,在周期表中的位置是第三周期第ⅠA族。
;D元素是Na,原子序数是11,在周期表中的位置是第三周期第ⅠA族。
(2)A、B、C和F可组成一种化合物,其原子个数之比为8∶2∶4∶1,因此该化合物是(NH4)2SO4,名称是硫酸铵;
(3)E2C3是氧化铝,属于两性氧化物,因此分别与盐酸和氢氧化钠溶液反应的离子方程式为Al2O3+6H+=2Al3++3H2O、Al2O3+2OH-+3H2O=2[Al(OH)4]- 或Al2O3+2OH-=2AlO2-+H2O;
(4)A、C、D、F可形成两种酸式盐分别为NaHSO3和NaHSO4,二者发生反应的离子反应为H++HSO3--=H2O+SO2↑;
(5)H、O、S形成的负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-,发生反应的离子反应为OH-+HS-=H2O+S2-;
(6)向含有a mol AlCl3的溶液中加入含b mol NaOH的溶液,发生反应:
①AlCl3+3NaOH=Al(OH)3↓+3NaCl
②AlCl3+4NaOH=NaAlO2+3NaCl
则当a:b≥1:3时,只发生反应①,二者恰好反应时得到沉淀为amol或b/3mol,氯化铝过量时,得到沉淀小于amol,可能为a/3mol;
当a:b≤1:4时,只发生反应②,没有沉淀生成,即沉淀为0;
当1:3<a:b<1:4时,发生反应①②,则:
AlCl3+3NaOH=Al(OH)3↓+3NaCl
xmol 3xmol xmol
AlCl3+4NaOH=NaAlO2+3NaCl
(a-x)mol 4(a-
则3xmol+4(a-x)mol=b,解得x=(4a-b),即沉淀为(4a-b)mol;由氢氧根守恒可知,氢氧化铝的物质的量不可能等于NaOH物质的量,即沉淀不能为bmol,综上分析可知,沉淀可能为①a mol、③a/3 mol、④b/3 mol、⑤0、⑥(4a-b)mol,不可能②b mol。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】(1)在一个小烧杯里加入约20g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后,再加入约10gNH4Cl晶体,并立即用玻璃棒迅速搅拌。使Ba(OH)2·8H2O与NH4Cl充分反应。实验中观察到的现象是______________________,说明该反应是___________热反应,这是由于反应物所具有的总能量_________ (填“大于”、“小于”或“等于”生成物所具有的总能量。
(2)将Fe+2FeCl3=3FeCl2设计为一个原电池,则该电池的负极材料为__________,正极电极反应式为__________________________________。
(3)恒温下,将amo1N2与bmolH2的混合气体通入一容积固定的密闭容器中,发生如下反应:N2(g)+ 3H2(g)![]() 2NH3(g)。若反应进行到时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=__________。反应达平衡时,混合气体的体积为716.8L(已经折算为标准状况下),其中NH3的体积分数为25%。则平衡时H2的转化率为____________________。
2NH3(g)。若反应进行到时刻t时,nt(N2)=13mol,nt(NH3)=6mol,则a=__________。反应达平衡时,混合气体的体积为716.8L(已经折算为标准状况下),其中NH3的体积分数为25%。则平衡时H2的转化率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了前20号元素中的某些元素性质的有关数据:
元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
最高价态 | +1 | +1 | +3 | +4 | +5 | +7 | +1 | +5 | ||
最低价态 | -2 | -4 | -3 | -1 | -3 | -1 |
试回答下列问题
(1) 以上10种元素的原子中,最易失去电子的是__________(填写元素符号)。
(2) 上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写出2种物质的分子式)_______________,______________
(3) ⑦元素在周期表中位于____________________________.
(4) 第三周期元素R的原子半径为1.02×10-10m,若物质Na2R3是一种含有非极性共价键的离子化合物,请写出该化合物的电子式:_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量的说法中正确的是( )
A.是表示物质多少的单位B.是表示物质数量的单位
C.是以克为单位的质量单位D.是国际单位制中七个基本物理量之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C(VitaminC)又名抗坏血酸,具有酸性和强还原性,也是一种常见的食品添加剂,其结构如图.下列有关说法中正确的是( ) 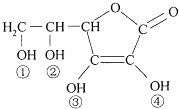
A.维生素C由于含有C═O键而能发生银镜反应
B.维生素C由于含有酯基而难溶于水
C.维生素C的分子式为C6H8O6
D.维生素C的酸性可能是①、②两个羟基引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B=3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com