
【题目】运输汽油的车辆,贴有的危险化学品标志是
A. B.
B. C.
C. D.
D.
【答案】D
【解析】
爆炸品一般指发生化学性爆炸的物品。本类化学品指在外界作用下(如受热、受压、撞击等),能发生剧烈的化学反应,瞬时产生大量的气体和热量,使周围压力急骤上升,发生爆炸,对周围环境造成破坏的物品。也包括无整体爆炸危险,但具有燃烧、抛射及较小爆炸危险的物品,或仅产生热、光、音响或烟雾等一种或几种作用的烟火物品。比如: 火药、 炸药、 烟花爆竹等,都属于爆炸品。
A.由分析可知,汽油不属于爆炸品,错误;
B.汽油是液体,不是气体,错误;
C. 腐蚀品是指能灼伤人体组织并对金属等物品造成损坏的固体或液体。如浓硫酸、硝酸、氢氧化钠等,汽油不属于腐蚀品。C错误;
D.汽油是易燃性液体,正确;
答案为D。


科目:高中化学 来源: 题型:
【题目】为探究Na与C02反应产物,某化学兴趣小组按如图装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3

回答下列问题:
(1)写出A中反应的离子方程式_____________________________________;
(2)仪器X的名称是____________________,B中的溶液为_____________________;
(3)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g.再进行下列实验操作,其正确顺序是____________(填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,通入C02至E中出现浑浊 e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是______________________________________;
(5)探究固体产物中元素Na的存在形式
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有
完成下列实验设计,验证上述假设:
步骤 | 操作 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
m1 | m2 | m3 |
66.7g | 69.0g | 72.lg |
(6)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备锌印刷电路板是用稀硝酸腐蚀锌板产生的废液称“烂板液”。“烂板液”中除含硝酸锌外,还含有自来水带入的Cl-和Fe3+,在实验室里,用“烂板液制取ZnSO47HO的过程如图所示
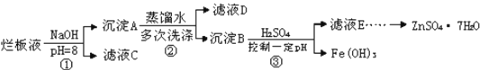
(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是_________
(2)若步骤①的pH>12,则Zn(OH) 2溶解生成偏锌酸钠,Zn(OH) 2溶解的离子方程式为___________________________
(3)滤液D中除了含有OH-离子外,还含有的阴离子有___________(填离子符号)
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,(Fe3+)=2.6×10-9mo·L-l试求出Fe(OH)3的溶度积常数________________(只写结果)
(5)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq)H=a kJ mol·L-1
②H2O(l) H+(aq)+OH-(aq)H=b kJ·mol·L-1
若①的溶度积常数为Ksp,②的离子积常数为Kw,Fe3+发生水解反应的平衡常数:K=______________(用含Kw、Ksp的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组报用含稀硫酸的KMnO4,溶液与H2C2O4溶液(弱酸)的反应(此反应为放热反应)来探究"条件对化学反应速率的影响",并设计了如表的方案记录实验结果(忽略溶液混合体积变化),限选试剂和仪器:0.2mol L-1H2C2O4溶液、0.010mol·L-1KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
项目 | V(0.2mol L-1H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010mol·L-1KMnO4溶液)/mL | M(MnSO4固体)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.0 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题
(1完成上述反应原理的化学反应方程式____________________________________
(2)上述实验①②是探究___________对化学反应速率的影响;若上述实验②③是探究浓度的对化学反应速率的影响,则a为______;乙是实验需要测量的物理量,则表格中“乙”应填写_______;上述实验②④是探究__________对化学反应速率的影响
(3)已知草酸为二元弱酸,其电离方程式为___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
![]()
下列说法中不正确的是( )
A. 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B. 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌锰干电池的负极材料是电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生Mn2O3。利用废旧电池回收Zn、Mn化合物,对环境保护意义重大。
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得到固体和滤液。
步骤二:处理固体,提取MnO2通过对获得的滤渣进行灼烧,灼烧的目的是__。灼烧时用到的实验仪器有酒精灯、玻璃棒、__。
步骤三:处理滤液,得到ZnCl2·xH2O晶体,再通过将SOCl2与ZnCl2·xH2O晶体混合可制取无水ZnCl2。有关的实验装置如图(夹持及加热装置略):
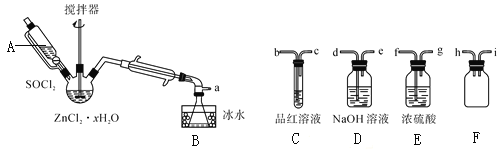
已知:SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃。140℃以上易分解,与水剧烈反应生成两种气体。
①仪器A的名称为__。
②蒸馏烧瓶中发生反应的化学方程式为:__。
③为回收剩余的SOCl2并验证生成物中含有SO2。上述仪器接目的连接响序为a→__。装置E中浓硫酸的作用___。
④为提高SOCl2的利用率,该实验宜采用的加热方式为__。
⑤讨论:将ZnCl2·xH2O晶体置于坩埚中加热均烧,__(能,不能)得到无水ZnCl2,原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol·L-1的盐酸,产生CO2气体的体积与所加盐酸体积之间的关系如图所示。下列判断正确的是
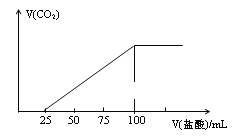
A.所得溶液溶质成分的物质的量之比为:n(NaHCO3):n(Na2CO3)=2: 1
B.所得溶液溶质成分的物质的量之比为:(NaOH):n(Na2CO3)=1: 3
C.原NaOH溶液的浓度为0.1mol/L
D.通入CO2体积为448mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,它的制取与应用一直是人类研究的热点。
(1)用甲醇和水蒸气在催化剂、加热条件下制氢的相关热化学方程式如下:
CH3OH(g)=CO(g)+2H2(g);ΔH=+90.7 kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g);ΔH=-41.2 kJ/mol
①反应CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)能自发进行的原因是________。
CO2(g)+3H2(g)能自发进行的原因是________。
②将一定比例的CH3OH(g)和H2O(g)的混合气体,以相同速率通过装有不同催化剂的反应器。CH3OH转化率随催化剂的使用时长变化如图1所示,催化剂CuAl2O4与催化剂Cu/Zn/Al相比,优点有____________________。
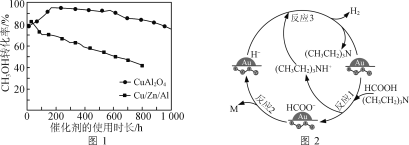
③向Cu(NO3)2、Al(NO3)3混合溶液中滴加NaOH溶液可获得沉淀物[Cu(OH)2、Al(OH)3],以便于制取CuAl2O4。为确保Cu2+、Al3+完全沉淀(浓度≤10-5 mol/L),应控制混合液pH的最小整数值为________{Ksp[Cu(OH)2]=2.2×10-20,Ksp[Al(OH)3]=1.3×10-33}。
(2)用Au/ZrO2作催化剂,在(CH3CH2)3N作用下HCOOH分解制氢的原理如图2所示。反应2中生成物M的化学式为__________________,图示反应中只有氢元素化合价发生变化的是反应________(填“1”“2”或“3”)。
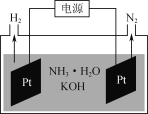
(3)如图是电解氨水和KOH混合溶液制氢的装置示意图。生成N2的电极反应式为______________。
(4)富氧条件下,H2还原NOx包括两个阶段:第一阶段为H2、NOx在催化剂作用下转变为H2O、N2、NH3;第二阶段NH3在载体酸的作用下生成NH4+,NH4+将NOx还原为N2。写出NO与O2的物质的量之比为1∶1时,NH4+与NO、O2反应生成N2的离子反应方程式:__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com