
���û�ѧԭ�����ԶԹ����ŷŵķ�ˮ�������Ƚ�����Ч��������������ij�������Ƹ﹤ҵ������Cr(III)�Ĵ����������£�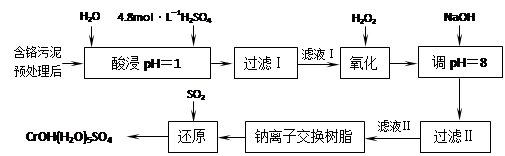
���������ȡҺ�еĽ���������Ҫ��Cr3+�������Fe3+��Al3+��Ca2+��Mg2+��
��1��ʵ������18.4 mol��L�D1��Ũ��������250 mL 4.8 mol��L�D1��������Һ�����õIJ����������ձ����������ͽ�ͷ�ι��⣬���� ��
��2�����ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ�� ��
��(д��������ʩ)
��3��H2O2�������ǽ���Һ���е�Cr3+ת��ΪCr2O72�D��д���˷�Ӧ�����ӷ���ʽ��
��
��4�������£�����������������������ʽ����ʱ��Һ��pH���£�
| ������ | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| ��ʼ����ʱ��pH | 2.7 | ���� | ���� | ���� |
| ������ȫʱ��pH | 3.7 | 11.1 | 8 | 9����9�ܽ⣩ |
��1��250mL����ƿ��1�֣�����Ͳ��1�֣�
��2�����߷�Ӧ�¶ȡ������������ı�������ӿ�����ٶȵȣ�3���д�2�㼴��2�֣�
��3��2Cr3+ + 3H2O2 + H2O �� Cr2O72��+ 8H+��2�֣�
��4��Na+��Mg2+��Ca2+��2�֣�
pH����8��ʹ����Al(OH)3�ܽ�����AlO2��������Ӱ��Cr(III)�����������ã�2�֣�
��5��Ca2+��Mg2+��2�֣�
��6��3SO2 + 2Na2CrO4 + 12H2O �� 2CrOH(H2O)5SO4��+ Na2SO4 + 2NaOH ��2�֣�
��3SO2 + 2CrO42�� + 12H2O �� 2CrOH(H2O)5SO4��+ SO42�� + 2OH����
����


 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
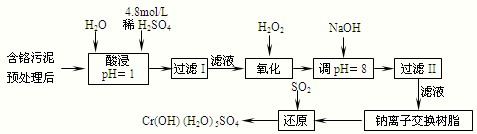
| ������ | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| ��ʼ����ʱ��pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| ������ȫʱ��pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 ����9�ܽ⣩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ������ | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| ��ʼ����ʱ��pH | 2.7 | -- | -- | -- |
| ������ȫʱ��pH | 3.7 | 11.1 | 8 | 9����9�ܽ⣩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 | 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡ2010������꼶��һ��ģ�⿼�Ի�ѧ���� ���ͣ������
��10�֣����û�ѧԭ�����ԶԹ����ŷŵķ�ˮ������Ч���ͺ���������
��1��Ⱦ�Ϲ�ҵ�ŷŵķ�ˮ�к��д����ж���NO2-�������ڼ��������¼������۳�ȥ(���ȴ�����ķ�ˮ�������ʹʪ���ɫʯ����ֽ����������)����ȥNO2-���ӵ����ӷ���ʽ��
�� ��
��2����ˮ�е�N��PԪ�������ˮ�帻Ӫ��������Ҫ���أ�ũҩ���ŷŵķ�ˮ�г����н϶��NH4+��PO43-��һ�����ͨ�����ַ��������ȥ��
�ٷ���һ����Ca(OH)2��CaOͶ�ӵ��������ķ�ˮ�У���������ƣ��Ӷ����л��ա���������ķ�ˮ��c��Ca2+��=2��10-7mol/Lʱ����Һ��c��PO43-��= ��
(��֪����ʱ����SP��Ca3��PO4��2��=2��10-33)
�ڷ��������ڷ�ˮ�м���þ��ҵ��ˮ���Ϳ������ɸ�Ʒλ����ʯ�������ʯ����Ӧ�ķ���ʽΪMg2++ NH4++ PO43-= MgNH4 PO4���÷�������Ҫ������ˮ��pHΪ7.5-10����pH����10.7�����ʯ�IJ������͡���ԭ������� �� ���뷽��һ��ȣ����������ŵ��� �� ��
��3��������ϩ��ӡˢ����֯����ҵӦ�ù㷺��Ϊ�˼�����Ի�����Ӱ�죬�ɽ�������ϩ�ڶ������ѱ�Ĥ�ϴ����⣬�䷴Ӧ�Ļ������£�

�÷�Ӧ���ܻ�ѧ����ʽΪ �� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com