
| A�� | M���⻯���ˮ��Һ����W��������Һ����Ӧ�õ�W���⻯�˵���ǽ�����M��W | |
| B�� | X��Y�γɵ�ԭ�Ӹ�����Ϊ1��1�ķ����м��Լ��ͷǼ��Լ�֮��Ϊ2��1 | |
| C�� | ZԪ������Ȼ���д�������̬ | |
| D�� | ԭ�Ӱ뾶�Ĵ�С˳��r��W����r��Z����r��Y�� |
���� ����������Ԫ��X��Y��Z��W��M��ԭ������������������Y��W��ԭ���������8��Y������ΪHԪ�أ��ʶ���ֻ��Ϊͬ����Ԫ�أ���YΪOԪ�ء�WΪSԪ�أ����ԭ��������֪MΪCl��Y��Z��W����ԭ�ӵ�����������֮��Ϊ16����Z������������Ϊ16-6-6=4����ZΪSi��X��Z��������ۺ�����۵Ĵ����;�Ϊ0��X������Ԫ�ؾ���λ��ͬһ���壬��Xֻ��ΪH��Ȼ����Ԫ�������ɼ�Ԫ�ػ�����֪ʶ�����
��� �⣺����������Ԫ��X��Y��Z��W��M��ԭ������������������Y��W��ԭ���������8��Y������ΪHԪ�أ��ʶ���ֻ��Ϊͬ����Ԫ�أ���YΪOԪ�ء�WΪSԪ�أ����ԭ��������֪MΪCl��Y��Z��W����ԭ�ӵ�����������֮��Ϊ16����Z������������Ϊ16-6-6=4����ZΪSi��X��Z��������ۺ�����۵Ĵ����;�Ϊ0��X������Ԫ�ؾ���λ��ͬһ���壬��Xֻ��ΪH��
A��HCl��Na2S����Һ��Ӧ����H2S��Ϊǿ����ȡ����ķ�Ӧ��������������������ԱȽϷǽ����ԣ���A����
B��X��Y�γ�ԭ�Ӹ�����Ϊ1��1�ķ���ΪH2O2��˫��ˮ�����к���2��H-O���Լ���1��O-O�Ǽ��Լ������м��Լ��ͷǼ��Լ�֮��Ϊ2��1����B��ȷ��
C��ZΪSiԪ�أ���Ԫ������Ȼ�����Ի���̬��ʽ���ڣ���C����
D��ͬ����ԭ���������ԭ�Ӱ뾶С����ԭ�Ӱ뾶�Ĵ�С˳��r��Z����r��W����r��Y������D����
��ѡB��
���� ���⿼��ԭ�ӽṹ��Ԫ�������ɵĹ�ϵ��Ϊ��Ƶ���㣬����Ԫ�ص�λ�á�ԭ�������Ĺ�ϵ�ƶ�Ԫ��Ϊ������Ĺؼ������ط������ƶ������Ŀ��飬ע��Ԫ�������ɼ�Ԫ�ػ�����֪ʶ��Ӧ�ã���Ŀ�ѶȲ���


 ������ÿ�ʱ��ҵϵ�д�
������ÿ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����0.1 mol•L-1 NaCl��Һʱ������һ���ǽ���ȷ������NaCl�����ձ��в���������ˮ�����ܽ� | |
| B�� | ����1 mol•L-1 NaOH��Һʱ�����ܽ���NaOH��Һ����ע������ƿ | |
| C�� | ����0.1 mol•L-1��H2SO4��Һʱ������ȡ��ŨH2SO4��������ƿ�м�ˮϡ�� | |
| D�� | ����1 mol•L-1 Na2CO3��Һ500 mL����Na2CO3����������ƽ���̳��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������� | B�� | ����̼��� | ||
| C�� | ��������Ȼ��� | D�� | �Ȼ��������۸��¹��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ǣ�C12H19Cl3O8��������Ȼ��������ζ�� | |
| B�� | δ�������ƻ��������Ʊ���ɫ������ƻ����֭�ܷ���������Ӧ | |
| C�� | ���������ķ��������������롢�ᴿ������ | |
| D�� | ��ȩ��֬���ϳ����л������������л��߷��ӻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
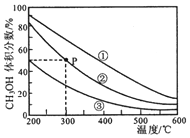
| A�� | �÷�Ӧ������ӦΪ���ȷ�Ӧ | |
| B�� | ���������ݻ����٣��ڣ��� | |
| C�� | ��P�㣬COת����Ϊ75% | |
| D�� | ��P�㣬�����������ٳ���CO��H2 �� CH3OH �� 0.025mol����ʱ v��CO������v ��CO���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | PH=7����Һ | |
| B�� | �ǵ��������ˮ�õ�����Һ | |
| C�� | ��ǿ���ǿ������ʵ�����Ӧ�õ������� | |
| D�� | c ��H+��=c ��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH2F2�ĵ���ʽ��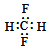 | |
| B�� | CH2=CH-CH2=CH2��ϵͳ����Ϊ��1��3-����ϩ | |
| C�� | ��Ư�۵Ļ�ѧԭ����2Cl2+2Ca��OH��2�TCaCl2+Ca��ClO��2+2H2O | |
| D�� | �Ʊ������������壺Fe3++3H2O$\frac{\underline{\;\;��\;\;}}{\;}$Fe��OH��3��+3H+ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com