
分析 (1)硫酸铁为强电解质,完全电离;
(2)二者反应生成硫酸钡与水;
(3)碳酸钙与盐酸反应生成氯化钙和二氧化碳和水;
(4)碳酸钾与盐酸反应生成二氧化碳和水、氯化钾,氯化钾与盐酸不反应;
(5)碳酸氢钠不稳定受热分解生成碳酸钠和水、二氧化碳.
解答 解:(1)硫酸铁为强电解质,完全电离,电离方程式:Fe2(SO4)3=2Fe3++3SO42-,
故答案为:Fe2(SO4)3=2Fe3++3SO42-;
(2)稀硫酸溶液中滴加氢氧化钡溶液至中性,离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(3)碳酸钙与盐酸反应生成氯化钙和二氧化碳和水,离子方程式:CaCO3+2H+=Ca2++H2O+CO2↑;
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(4)碳酸钾与盐酸反应生成二氧化碳和水、氯化钾,离子方程式:CO32-+2H+=H2O+CO2↑,氯化钾与盐酸不反应,可以用盐酸鉴别;
故答案为:稀盐酸;CO32-+2H+=H2O+CO2↑;
(5)碳酸氢钠不稳定受热分解生成碳酸钠和水、二氧化碳,化学方程式:2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
故答案为:2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
点评 本题考查了离子方程式、化学方程式的书写,明确反应实质是解题关键,解答时应注意反应必须遵循客观事实,题目难度不大.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 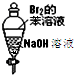 振荡后静置,溶液不再分层,且保持无色透明 | |
| B. |  铁片最终完全溶解,且高锰酸钾溶液变无色 | |
| C. |  微热稀HNO3片刻,溶液中有气泡产生,广口瓶内出现红棕色气体 | |
| D. |  当溶液至红褐色,停止加热,液体变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27 g铝原子最外层电子总数为NA | |
| B. | 2.8 g N2和2.8 g NO2所含电子数均为1.4NA | |
| C. | 1 L 0.1 mol•L-1乙酸溶液中H+数为0.1NA | |
| D. | 标准状况下,22.4 L甲烷的分子数NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
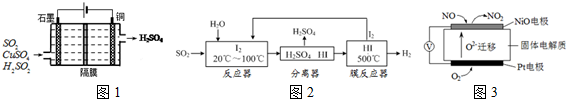
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验②证明Fe2+既有氧化性又有还原性 | |
| B. | 上述实验中,有一个氧化还原反应 | |
| C. | 实验①生成的气体不能使湿润的淀粉KI试纸变蓝 | |
| D. | 上述实验证明氧化性:MnO4->Cl2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
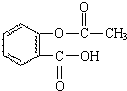 化学和环境保护、食品营养、材料应用等密切相关.
化学和环境保护、食品营养、材料应用等密切相关. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com