
����Ŀ��һ���¶��£���1.0L���ܱ������м���0.60molX��g����������ӦX(g)![]() Y(s)+2Z(g)����÷�Ӧ��X��Ũ���뷴Ӧʱ��Ĺ�ϵ�����ʾ��
Y(s)+2Z(g)����÷�Ӧ��X��Ũ���뷴Ӧʱ��Ĺ�ϵ�����ʾ��
��Ӧʱ��t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
c(X)/(mol��L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
(1)0��3min����Z��ʾ��ƽ����Ӧ�ٶ�v(Z)=___��
(2)�����÷�Ӧ�з�Ӧ���Ũ����ʱ��Ĺ�ϵ���ó��Ľ�����___���ɴ˹����Ƴ���6minʱ��Ӧ��X��Ũ��Ϊ___mol��L-1��
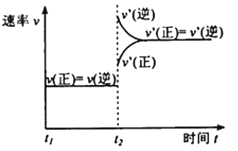
(3)�÷�Ӧ���淴Ӧ������ʱ��仯��������ͼ��ʾ��t2ʱ�ı������������___��___��
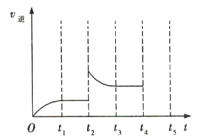
���𰸡�0.26mol��L-1��min-1 ÿ��2minX��Ũ�ȼ���Ϊԭ����һ�� 0.075 ����Z ������ϵ��ѹǿ
��������
(1)0��3min�ڿ������X��ʾ��ƽ����Ӧ���ʣ�Ȼ�����û�ѧ��������ϵ�����Z��ʾ��ƽ����Ӧ�ٶ�v(Z)��
(2)�����÷�Ӧ�з�Ӧ���Ũ����ʱ��Ĺ�ϵ��Ѱ�ҹ������ݵĹ����ԣ��ɴ˵ó��Ľ��ۡ��ɴ˹��ɿ��Ƴ���6minʱ��Ӧ��X��Ũ�ȡ�
(3)���ݷ�Ӧ��t2ʱ�ı��������Ũ�ȡ�ѹǿ���¶ȡ��������������з�����
(1)0~3min�ڣ�c(X)=(0.60-0.21)mol/L=0.39mol/L��ƽ����Ӧ����v(X)=![]() = 0.13mol��L-1��min-1����v(Z)=2v(X)����v(Z)=0.26mol��L-1��min-1����Ϊ��0.26mol��L-1��min-1��
= 0.13mol��L-1��min-1����v(Z)=2v(X)����v(Z)=0.26mol��L-1��min-1������0.26mol��L-1��min-1��
(2)���ݱ������ݿ�֪��ÿ��2min��X��Ũ�ȼ���Ϊԭ����һ�룬�ɴ˹����Ƴ���6minʱ��Ӧ��X��Ũ��Ϊ0.075 mol��L-1����Ϊ��0.075��
(3)![]() ʱ�̣�
ʱ�̣�![]() ˲�������ܵ�ԭ���Ǽ���������Z��������ϵ��ѹǿ����Ϊ������Z��������ϵ��ѹǿ��
˲�������ܵ�ԭ���Ǽ���������Z��������ϵ��ѹǿ����Ϊ������Z��������ϵ��ѹǿ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25��ʱ����������ʵĵ���ƽ�ⳣ�����������ʾ���ش��������⣺
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | Ka=1.8��10��5 | Ka1=4.3��10��7 Ka2=5.6��10��11 | Ka=3.0��10��8 |
��1�����ʵ���Ũ�Ⱦ�Ϊ0.1molL��1��������Һ��pH��С�������е�˳����_______���ñ����д��
a��CH3COONa b��Na2CO3 c��NaClO d��NaHCO3
��2�������£�0.1molL��1 CH3COOH��Һ��ˮϡ�����У����б���ʽ�����ݱ�����_____������ĸ��_______
A. c��H+�� B.![]() C. c��H+��c��OH���� D.
C. c��H+��c��OH���� D. ![]() E.
E. ![]()
��3��д�������������Һ��ͨ������������̼�����ӷ���ʽ��__________________
��4��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH=6������Һ��
c��CH3COO������c��Na+��=________����ȷ��ֵ����
��5��25��ʱ����a molL��1�Ĵ�����b molL��1�������Ƶ������ϣ���Ӧ����Һǡ�������ԣ���a��b��ʾ����ĵ���ƽ�ⳣ��Ϊ____________________________________
��6����״���£���1.12L CO2ͨ��100mL 1molL��1��NaOH��Һ�У�����Һ������Ũ�ȷ���������е�ʽ�� c��OH����=2c��H2CO3��+_________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʹ������һ������������ķ����忹��ҩ����ϳ�·�����£�
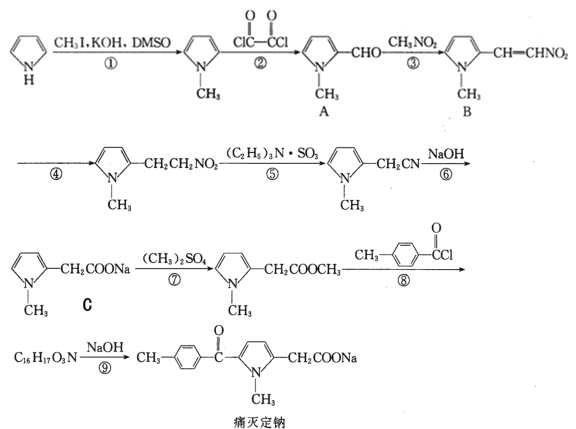
�ش��������⣺
(1)������ C �к��������ŵ�������_____��
(2)��ѧ��Ӧ�ٺܵ͢ķ�Ӧ���ͷֱ�Ϊ_____��_____��
(3)���й���ʹ���Ƶ�˵����ȷ����_____��
a��1mol ʹ�����������ӳ�������� 7molH2 b���˴Ź����������ܹ���ʾ 6 ���� c�����ܹ�������ԭ��Ӧ d�������ּӳɺ���������������� e����ֱ�ߵ�̼ԭ������� 4 ��
(4)��Ӧ��Ļ�ѧ����ʽΪ_____��
(5)�����廯���� X ����Է��������� A �� 14���� FeCl3 ��Һ����ɫ�Ľṹ����_____�֣������������칹�����˴Ź�����������ʾ�� 5 ����� X �Ľṹ��ʽ��_____��
(6) ���ݸ������ṩ�������Ϣ��д���ɻ�����![]() ����Ҫ���Լ��Ʊ��л�������
����Ҫ���Լ��Ʊ��л�������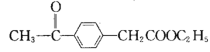 �ĺϳ�·��ͼ��________________
�ĺϳ�·��ͼ��________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������![]() ��Ŀ�����������о���֧��
��Ŀ�����������о���֧��![]() ��һ�������¾���������ʾ��ת����ϵ��
��һ�������¾���������ʾ��ת����ϵ��

�ش�
(1)![]() �Ľṹ��ʽΪ______��C��D�����ϵΪ______��
�Ľṹ��ʽΪ______��C��D�����ϵΪ______��
(2)ָ������ת�����л���Ӧ���ͣ�![]() ��______���ͣ�
��______���ͣ�![]() ��______���͡�
��______���͡�
(3)����B�ķ�Ӧ����ʽΪ��______��
(4)����C�ķ�Ӧ����ʽΪ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��ϵͳ��������д�����л�������ƣ�![]() ��������__________________________��
��������__________________________��
(2)2,6��������4���һ�����Ľṹ��ʽ��________��1mol������ȫȼ������������________mol��
(3)�����ķ��ӽṹ�У���ÿ����2����ԭ�ӣ����൱��̼̼������1�Թ��õ��ӡ�������������⣺
�ٷ���ʽΪCnH2n��2����������̼̼�乲�õ��Ӷ���Ϊ________��
�ڷ��ϸ������ĵ�ϩ���ķ���ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��״����CH4�����Ϊ4.48L������������ʵ���Ϊ___________��������Ϊ___________�� ԭ����ԼΪ___________��������Ϊ___________��������Ϊ___________��Ħ������Ϊ___________������Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2������ȫ������ձ����ӡ�Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽���÷�Ӧԭ������������ʵ�飺���ݻ�Ϊ1L���ܱ������У�����1mol CO2��3mol H2����500���·�����Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)��ʵ����CO2��CH3OH(g)�����ʵ���(n)��ʱ��仯��ͼ��ʾ��
CH3OH(g)+H2O(g)��ʵ����CO2��CH3OH(g)�����ʵ���(n)��ʱ��仯��ͼ��ʾ��
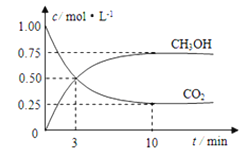
(1)�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)=________________����ͼ�Ǹı��¶�ʱ��ѧ��Ӧ������ʱ��仯��ʾ��ͼ����÷�Ӧ������ӦΪ____________��Ӧ������ȡ������ȡ�����
(2)500��÷�Ӧ��ƽ�ⳣ��Ϊ______��������λС������������¶ȵ�800����У���ƽ��ʱ��Kֵ______�����������С�����䡱����
(3)500�������£����ijʱ�̣�CO2(g)��H2(g)��CH3OH(g)��H2O(g)��Ũ�Ⱦ�Ϊ0.5mol/L�����ʱv(��)______v(��)�����������������=������
(4)���д�ʩ��ʹ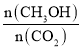 �������______��
�������______��
A�������¶� B����ԭ�����г���1molHe
C����ˮ��������ϵ�з���� D����С�����ݻ�������ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���(Li)-������صĹ���ԭ����ͼ��ʾ������˵������ȷ����( )
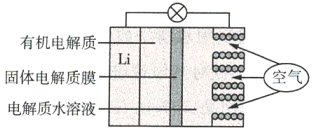
A.�����������������������Ӧ
B.Li+ͨ���л��������ˮ��Һ���ƶ�
C.�����ĵ缫��Ӧ��O2+4e-=2O2-
D.����ܷ�Ӧ��4Li+O2+2H2O=4LiOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F���ֶ�����Ԫ�ص�ԭ��������������Ԫ��A��ij�ֺ��������ӣ�BԪ�ص��������������۴�����Ϊ2��CԪ�غ�EԪ��ͬ���壬��EԪ�ص���ۺ�����Ϊ��Ԫǿ�ᣬDԪ����ͬ����Ԫ�������Ӱ뾶��С��Ԫ�ء���ش��������⣺
��1��A��BԪ����ɵĻ�����B2A4�ĵ���ʽΪ _______________��
��2��D������������F����ۺ����ᷴӦ�����ӷ���ʽ________________________��
��3��CԪ�غ�EԪ�ص���ͼ��⻯��ķе�C __________E(����ڻ�С��)������_________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com