
(10分)
Ⅰ.向FeCl3溶液中加入铁粉和铜粉混合粉末,充分反应后,下列情况可能存在的是 (填序号)

Ⅱ.今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3,溶液(其他用品略),某课外活动小组同学的实验结果如下(假定反应前后溶液体积不变)。

(1)试判断第④组剩余固体质量x为 。第①组实验中,发生反应的离子方程式为 。
(2)试判断第②组剩余固体的成分为 。
(3)原混合粉末中Fe、Cu的物质的量之比为 。
(共10分)
Ⅰ.②③⑥⑦(2分,对4个得2分、对3个得1分、对2个或1个、错一个均无分)
Ⅱ.(1) 0 (2分) 2Fe3++ Fe=3Fe2+(2分)
(2)Cu(2分) (3) 6﹕1(2分)
【解析】
试题分析:Ⅰ.①④、在金属活动性顺序中,铁在铜的前面,铁能与铜盐溶液发生置换反应,向装有氯化铁溶液的烧杯中,加入一定量的Cu和Fe的混合粉末,则铁优先与氯化铁发生反应生成氯化亚铁,然后铜与氯化铁反应生成氯化铜和氯化亚铁,故滤液中一定含有氯化亚铁,故①④错误;②③、充分反应后发现有铜剩余,则溶液中一定无氯化铁,一定有FeCl2,可能有CuCl2,故②③正确;⑤若有铁剩余,则溶液中一定不含氯化铜和氯化铁,故⑤错误;⑥充分反应后没有固体剩余,则可能是氯化铁还会剩余,金属量不足的情况,故⑥正确;⑦充分反应后发现铜、铁都存在,则滤液中一定不含有氯化铁、氯化铜,只有氯化亚铁,故⑦正确,所以答案为:②③⑥⑦
Ⅱ.(1)第④组实验,可以看作再第②组实验的基础上再加入50mL FeCl3溶液,发生Cu+2Fe3+=Fe2++Cu2+,50mL溶液可以溶解Cu的质量=0.05L×4mol/L×1/2×64g/mol=6.4g,故x=6.4g-6.4g=0;;第①组实验Fe3+还未反应完,所以发生反应的离子方程式为:2Fe3++ Fe=3Fe2+
(2)铁的还原性强于铜,所以Fe3+先和铁反应:Fe+2Fe3+=3Fe2+,反应完全后Fe3+有剩余,再与铜发生反应:Cu+2Fe3+=Fe2++Cu2+,能剩余的固体可以是铜,可以是铁和铜,第②组实验中,有固体剩余,故FeCl3溶液全部参与反应,若只发生Fe+2Fe3+=3Fe2+,可以溶解Fe的质量为0.3L×4mol/L×1/2×56g/mol=33.6g,300mL FeCl3溶液能溶解金属质量40g-6.4g=33.6g,第③组实验,可以看作再第②组实验的基础上再加入30mL FeCl3溶液,实际溶解金属质量=6.4g-2.56g=3.84g,若只发生Fe+2Fe3+=3Fe2+,30mL溶液可以溶解Fe的质量为0.03L×4mol/L×1/2×56g/mol=3.36g,若只发生Cu+2Fe3+=Fe2++Cu2+,30mL溶液可以溶解Cu的质量为0.03L×4mol/L×1/2×64g/mol=3.84g,可推断第②组实验中Fe恰好反应完全,剩余固体为Cu
(3)根据(1)中分析可知Cu为6.4g,Fe的质量=40g-6.4g=33.6g,故n(Fe)=33.g÷56g/mol=0.6mol,n(Cu)=6.4g÷64g/mol==0.1mol,原混合粉末中Fe、Cu的物质的量之比=0.6mol:0.1mol=6:1。
考点:本题考查氧化还原反应原理及反应顺序、混合物的计算、离子方程式的书写。


科目:高中化学 来源:2015届湖北黄冈蕲春县第一高级中学高二下期中考试化学卷(解析版) 题型:选择题
下图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是( )
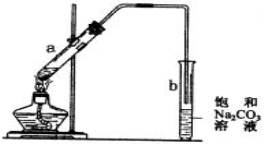
A. 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
B. 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
C. 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
D. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高三十月阶段性考试化学试卷(解析版) 题型:选择题
已知下列物质的名称分别是
名称 | 硫代硫酸钠 | 多硫化钙 | 过氧化钡 | 超氧化钾 |
化学式 | Na2S2O3 | CaSx | BaO2 | KO2 |
根据上述命名规律回答:K2CS3应命名为
A.三硫代碳酸钾 B.多硫碳酸钾 C.过硫碳酸钾 D.超硫碳酸钾
查看答案和解析>>
科目:高中化学 来源:2015届湖北省四校高三上学期期中联考化学试卷(解析版) 题型:选择题
有Fe2+、NO3—、Fe3+、NH4+、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
A.氧化剂和还原剂的物质的量之比为1:8
B.该过程说明Fe(NO3)2溶液不宜加酸酸化
C.每1molNO3—发生氧化反应,转移8mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+—e–=Fe3+
查看答案和解析>>
科目:高中化学 来源:2015届湖北省四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是( )
A.硫酸铝溶液中滴加过量浓氨水:Al3++4OH-===AlO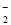 +2H2O
+2H2O
B.用过氧化氢从酸化的海带灰浸出液中提取碘:2I—+H2O2+2H+=I2+2H2O
C.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O
D.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
查看答案和解析>>
科目:高中化学 来源:2015届湖北省咸宁市高三三校联考化学试卷(解析版) 题型:填空题
(6分)A、B、C、D、E、F六种原子序数依次增大的短周期元素。A与其余五种元素既不同周期,也不同主族;B、C、D、E、F五种元素分别位于五个相邻的主族,原子序数之和为54,其中B的单质为空气中的主要成分之一。
(1)A、B形成的化合物液态时可发生微弱电离,电离产生的阴离子的电子式为_______________。
(2)某含F的盐矿石的组成可以看作其氧化物中有1/4的F被E替换,再由D平衡其电荷形成的。该矿石的化学式为 。(用氧化物形式表示)
(3)工业中制备单质E的阳极电极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省咸宁市高三三校联考化学试卷(解析版) 题型:选择题
A、B、C、D为四种短周期元素,已知A、C同主族,B、C、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是
A.原子序数:A>C>B>D B.单质熔点:D>B,A>C
C.原子半径:D>B>C>A D.简单离子半径:D>B>C>A
查看答案和解析>>
科目:高中化学 来源:2015届海南省高三第四次月考化学试卷(解析版) 题型:推断题
已知A为常见的金属单质,根据如图所示的转化关系回答下列问题。

(1)确定A、B、C、D、E、F的化学式:
A为________,B为________,C为________。
D为________,E为________,F为________。
(2)写出⑧的化学方程式及④、⑤的离子方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期回头考试化学试卷(解析版) 题型:选择题
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g) 2XY3(g) △H=-92.6 kJ.mol-1
2XY3(g) △H=-92.6 kJ.mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | |||
① | 1 | 3 | 0 | 2分钟 | 放热46.3kJ |
② | 0.4 | 1.2 | 1.2 | / | Q(Q>0) |
下列叙述不正确的是
A.容器①中反应从开始到刚达平衡时用XY3表示的反应速率为v(XY3)=1/30 moI.L-l·s-1
B.平衡时,两个容器中XY3的物质的量浓度相等
C.容器②中反应达到平衡时吸收的热量为Q
D.容器①体积为0.3L,则达平衡时放出的热量大于46.3kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com