
 .
.分析 (1)光化学烟雾是汽车、工厂等污染源排入大气的碳氢化合物(HC)和氮氧化物(NOx)等一次污染物在阳光(紫外光)作用下会发生光化学反应生成二次污染物,参与光化学反应过程的一次污染物和二次污染物的混合物(其中有气体污染物,也有气溶胶)所形成的烟雾污染现象;
(2)A.亚硝酸钠有毒;
B.婴儿食品不能添加着色剂;
C.甲醛有毒,危害人体健康;
D.豆制品富含蛋白质;
(3)人体补钙的途径很多,经常晒太阳有利于促进人体对钙的吸收,经常饮用钙离子含量高的硬水,不能补钙,且喝时间长了容易得肾结石,可以适当服用补钙口服液,摄入牛奶、豆奶等营养品;
(4)依据题意小猫若无其事的站在一块高分子合成材料板上,板下烈火灼烧,说明该材料具有绝热性;
(5)①在潮湿的环境中,钢铁形成原电池而发生电化学腐蚀,防止腐蚀的方法有:隔绝空气或水、改变物质结构等;
②塑料、合成橡胶、合成纤维等都属于有机合成材料;在一定条件下,乙烯发生加成聚合反应生成聚乙烯;
(6)A.创可贴可以治疗外部小伤口,是皮肤表面用药;
B.胃舒平主要成分是氢氧化铝,能够治疗胃酸过多;
C.板蓝根冲剂有清热解毒作用,可以用于治疗感冒;
D.风油精对头痛、风湿骨痛、牙痛、晕车晕船、虫子叮咬等都有一定疗效;
解答 解:(1)A.SO2气体形成酸雨的主要成分,故A错误;
B.NO2是形成光化学烟雾的主要物质,故B正确;
C.CO2是形成温室效应的一种气体,故C错误;
D.CO有毒,能与人体中血红蛋白结合而使人产生中毒,故D错误;
故选:B;
(2)A.亚硝酸钠多加有毒,能致癌,不能过度使用,故A错误;
B.婴儿的抵抗力弱,身体素质不高,着色剂中的化学成分,影响婴儿健康,故B错误;
C.居室简单装修可减少室内甲醛污染,有利于身体健康,故C正确;
D.豆制品富含蛋白质,可补充蛋白质,故D错误;
故选:C;
(3)A.经常晒太阳有利于促进人体对钙的吸收,故A正确;
B.适量饮用葡萄糖酸钙口服液可以补充钙元素,故B正确;
C.牛奶、豆奶含有钙元素,能够补充钙,故C正确;
D.经常饮用钙离子含量高的硬水,不能补钙,且喝时间长了容易得肾结石,故D错误;
故选:D;
(4)小猫能站在放在高温火焰上得高分子合成材料上,说明该材料上面不热,该材料具有良好的绝热性,故选:A;
(5)①在潮湿的环境中,铁、碳和电解质溶液构成原电池而产生电流,所以主要发生电化学腐蚀;
金属腐蚀防护的方法有:电镀、涂油漆等;
故答案为:电化学;刷油漆;
②塑料、合成橡胶、合成纤维等都属于有机合成材料;在一定条件下,乙烯发生加成聚合反应生成聚乙烯,化学方程式: ,
,
故答案为:合成纤维; ;
;
(6)①可治疗感冒的药物是板蓝根;
②可抑酸止胃痛、助消化的是胃舒平;
③可防止蚊虫叮咬的药物是风油精;
故选:C、B、D.
点评 本题为综合题,考查了生活中常见的化学知识,设计材料的分类、金属的腐蚀与防护、药物的成分和疗效,掌握基础是解题关键,题目难度不大,注意积累.


科目:高中化学 来源: 题型:填空题
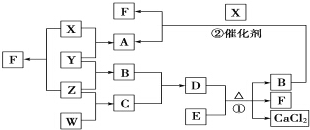 X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系:
X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系: ,F中的化学键类型为共价键.
,F中的化学键类型为共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2C2O4溶液呈碱性:C2O42-+2H2O═H2C2O4+2OH- | |
| B. | AgOH溶解在氨水里:AgOH+2NH3•H2O═[Ag(NH3)2]++2H2O | |
| C. | 钢铁发生电化腐蚀的负极反应:Fe-3e-═Fe3+ | |
| D. | 淀粉KI试纸经硫酸酸化后在空气中变蓝:4I-+O2+2H2O═2I2+4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
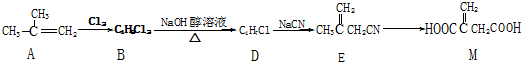
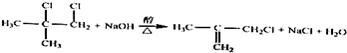
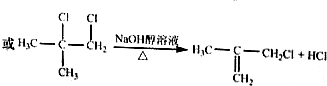 .
. (只写一种)
(只写一种)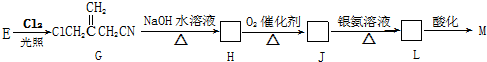
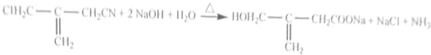
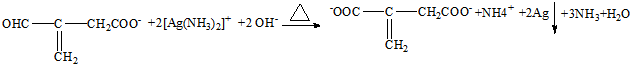
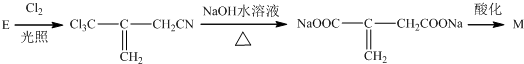 (实例如图1);第二步反应试剂及条件限用NaOH水溶液、加热)
(实例如图1);第二步反应试剂及条件限用NaOH水溶液、加热)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3 的水溶液:NaHCO3═Na++H++CO32- | |
| B. | 熔融状态的NaHSO4:NaHSO4═Na++HSO4- | |
| C. | HF的水溶液:HF═H++F- | |
| D. | H2S 的水溶液:H2S?2H++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠可用于泡沫灭火剂 | B. | 明矾能做净水剂 | ||
| C. | 氯气可作自来水消毒剂 | D. | 铝热反应可用来焊接钢轨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com