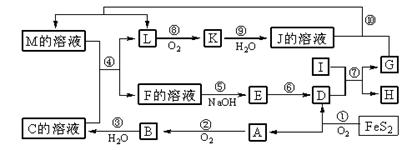
ñøö—ȤFeS
2î¾£₤çûç§çáA¢èØå¥äŽݣ₤Șå·AöˆSO
2ȘBöˆSO
3ȘCöˆBçáùÛ£₤öÿȘCöˆH
2SO
4ȘDöˆFe
2O
3ȘIòúçÖà»øÉóÖ¯ŠƒÑæŸÅÀçá§Þò¶åˆùÄæÕ°èçáçËøòȘÆÎöˆAlȘñÇÆÎÂÔöˆôêçËøòÆŠ§Þò¶î¾£₤öÿùªñÂèºçáøû££ñÇÆÎȘ¥ÇôêààñÇÆÎÈÛKòúØ£øø¤šæÄè¨ó½äÍȘöˆNO
2Șå·JöˆHNO
3ȘLݣ₤°èöˆNO
2Ș¿òL¢èáÉöˆ¯Ý£·NO
2ȘÆèÆÖCàÉؤȘ¥Çê·ùÃàÉؤáÉÆŠá°MàÉؤñÇÆÎçûç§LȘ¿òLý£¢èáÉòú¥ŸÅåçáó½äͯÝó½È˜¿òLöˆNOȘGáÉÆŠü¾ùÃñÇÆÎýÂáÉýºèºNOȘ¿òGöˆFeȘHöˆAl
2O
3ȘÆèñÇÆÎ4FeS
2+11O
2 2Fe
2O
3+8SO
2Ș₤çûç§çáA¢èØå¥äŽݣ₤Șå·AöˆSO
2ȘBöˆSO
3ȘCöˆBçáùÛ£₤öÿȘCöˆH
2SO
4ȘDöˆFe
2O
3ȘÆèKòúØ£øø¤šæÄè¨ó½äÍȘKöˆNO
2ȘJöˆHNO
3ȘIöˆçÖà»ø¼æÍàÜçÐ柡Ôçá§Þò¶È˜ÆÎöˆAlȘñÇÆÎÂÔöˆôêçËøòÆŠ§Þò¶î¾£₤öÿùªñÂèºçáøû££ñÇÆÎȘGáÉÆŠü¾ùÃñÇÆÎýÂáÉýºèºNOȘ¿òGöˆFeȘHöˆAl
2O
3ȘLöˆNOȘMÆÎöˆFeÈ´NO
3Èˋ
3£·FeÈ´NO
3Èˋ
2È£êˆüçñÇÆÎÂÉȤM+H
2SO
4 ÀºF+NOÀ■øˆÈ˜MöˆFeÈ´NO
3Èˋ
2ȘñÇÆÎøÅü¾ùáªÆÅòÈÆÁȘFöˆFeÈ´NO
3Èˋ
3£·Fe
2È´SO
4Èˋ
3ȘEÆÎöˆFeÈ´OHÈˋ
3Ș§Ã¤üÑåÆÎöÿøòçáÅåøò¤ëäãá¢Øˆúµ§ãÇÞ¡ûäãÈÛ
§ãÇÞȤ§ãȤFeS
2î¾£₤çûç§çáA¢èØå¥äŽݣ₤Șå·AöˆSO
2ȘBöˆSO
3ȘCöˆBçáùÛ£₤öÿȘCöˆH
2SO
4ȘDöˆFe
2O
3ȘIòúçÖà»øÉóÖ¯ŠƒÑæŸÅÀçá§Þò¶åˆùÄæÕ°èçáçËøòȘÆÎöˆAlȘñÇÆÎÂÔöˆôêçËøòÆŠ§Þò¶î¾£₤öÿùªñÂèºçáøû££ñÇÆÎȘ¥ÇôêààñÇÆÎÈÛKòúØ£øø¤šæÄè¨ó½äÍȘöˆNO
2Șå·JöˆHNO
3ȘLݣ₤°èöˆNO
2Ș¿òL¢èáÉöˆ¯Ý£·NO
2ȘÆèÆÖCàÉؤȘ¥Çê·ùÃàÉؤáÉÆŠá°MàÉؤñÇÆÎçûç§LȘ¿òLý£¢èáÉòú¥ŸÅåçáó½äͯÝó½È˜¿òLöˆNOȘGáÉÆŠü¾ùÃñÇÆÎýÂáÉýºèºNOȘ¿òGöˆFeȘHöˆAl
2O
3ȘÆèñÇÆÎ4FeS
2+11O
2 2Fe
2O
3+8SO
2Ș₤çûç§çáA¢èØå¥äŽݣ₤Șå·AöˆSO
2ȘBöˆSO
3ȘCöˆBçáùÛ£₤öÿȘCöˆH
2SO
4ȘDöˆFe
2O
3ȘÆèKòúØ£øø¤šæÄè¨ó½äÍȘKöˆNO
2ȘJöˆHNO
3ȘIöˆçÖà»ø¼æÍàÜçÐ柡Ôçá§Þò¶È˜ÆÎöˆAlȘñÇÆÎÂÔöˆôêçËøòÆŠ§Þò¶î¾£₤öÿùªñÂèºçáøû££ñÇÆÎȘGáÉÆŠü¾ùÃñÇÆÎýÂáÉýºèºNOȘ¿òGöˆFeȘHöˆAl
2O
3ȘLöˆNOȘMÆÎöˆFeÈ´NO
3Èˋ
3£·FeÈ´NO
3Èˋ
2È£êˆüçñÇÆÎÂÉȤM+H
2SO
4 ÀºF+NOÀ■øˆÈ˜MöˆFeÈ´NO
3Èˋ
2ȘñÇÆÎøÅü¾ùáªÆÅòÈÆÁȘFöˆFeÈ´NO
3Èˋ
3£·Fe
2È´SO
4Èˋ
3ȘEÆÎöˆFeÈ´OHÈˋ
3Ș
È´1ÈˋÆèØåèüñøö—¢èøˆAöˆSO
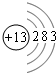
2ȘIöˆAlȘåÙæƤùëãçÓæÆò»öˆ13Ș§Ã¿¿òƒØãë¥öˆ
Ș¿òÇÞ¯¡öˆÈ¤SO
2È£

È£
È´2ÈˋÆèØåèüñøö—¢èøˆGöˆFeȘòú26¤éåˆùÄȘö£ÆÖøÉóÖÝÚçÖùáøÉóÖçÖ½æÍȘ¿òÇÞ¯¡öˆÈ¤çÖùáøÉóÖçÖ½æÍÈ£
È´3ÈˋñÇÆÎÂÔöˆAlÆŠFe
2O
3ùªñÂèºçáøû££ñÇÆÎȘñ§°äò§öˆ2Al+Fe
2O
32Fe+Al
2O
3ȘñÇÆÎøÅäºåˆùÄ£₤¤ü¥ÜÆè+3¥Ü§ççëöˆ0¥ÜȘ0.3molçÓæÆæˆØóòÝȘ躰èFeçáöÿøòçáê¢öˆ
=0.1molȘ¿òÇÞ¯¡öˆÈ¤2Al+Fe
2O
32Fe+Al
2O
3ȣ0.1molȣ
È´4ÈˋåÖñÇÆÎÂÖÀÂÂÜÀÂÂßÀÂÂÃøÅȘÂÖÀÂÂßÀÂÂÃÑ¥öˆî¾£₤£¿åÙñÇÆÎȘÂÜöˆSO
3+H
2O=H
2SO
4çáñÇÆÎȘ¥àò¶ÆÖ£₤¤üñÇÆÎÆøò¶ÆÖñúî¾£₤£¿åÙñÇÆÎȘ¿òÇÞ¯¡öˆÈ¤ÂÜÈ£
È´5ÈˋMøŤ˜ÆÅFe
2+¤ëNO
3-ȘåÖùÃÅåä¾¥±üô¢èñÂèºî¾£₤£¿åÙñÇÆÎȘñÇÆÎçáâŠæÆñ§°äò§öˆFe
2++4H
++NO
3-=3Fe
3++NOÀ■+2H
2OȘ
¿òÇÞ¯¡öˆÈ¤Fe
2++4H
++NO
3-=3Fe
3++NOÀ■+2H
2OÈ£
È´6Èˋ£₤¤üöÿFe
2O
3ÆŠKNO
3ÀÂKOH¿ýàÖȘ¢èøóçûØ£øøÀ¯ôäè¨ÀÝ£ñÝÈ¡ÔÅσ£ùÛ¥êK
2FeO
4Șë˜òÝ£¿èº°èKNO
2¤ëH
2OȘñÇÆÎñ§°äò§öˆFe
2O
3+3KNO
3+4KOH
2K
2FeO
4+3KNO
2+2H
2OȘ
¿òÇÞ¯¡öˆÈ¤Fe
2O
3+3KNO
3+4KOH
2K
2FeO
4+3KNO
2+2H
2OÈÛ




 Ș¿òÇÞ¯¡öˆÈ¤SO2È£
Ș¿òÇÞ¯¡öˆÈ¤SO2È£ È£
È£

 òŸ¥ìæ¼ØçòŸ¥ì¢šâøêñö¼¯ý°—¯ÌèÓüçêÅÇÞ¯¡
òŸ¥ìæ¼ØçòŸ¥ì¢šâøêñö¼¯ý°—¯ÌèÓüçêÅÇÞ¯¡