
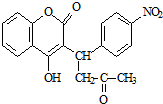
 ,醋硝香豆素可以通过以下方法合成(部分反应条件省略).
,醋硝香豆素可以通过以下方法合成(部分反应条件省略).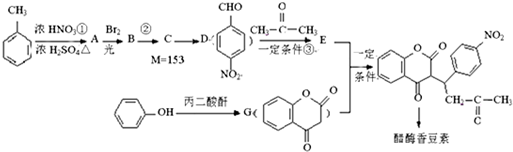
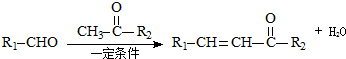
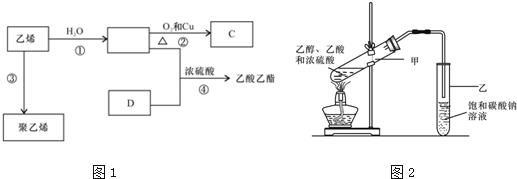
 ;反应②的反应类型水解反应或取代反应.
;反应②的反应类型水解反应或取代反应.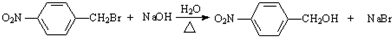 .
.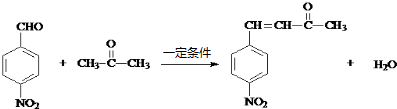 .
.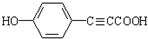 .
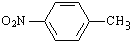
. 分析 甲苯和硝酸发生取代反应生成A,根据D的结构知,A的结构简式为 ,B的结构简式为
,B的结构简式为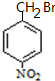 ,结合C相对分子质量知,C的结构简式为
,结合C相对分子质量知,C的结构简式为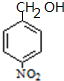 ,D和丙酮反应生成E,E的结构简式为
,D和丙酮反应生成E,E的结构简式为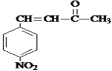 ,苯酚和丙二酸酐反应生成G,E和G反应生成醋酸香豆素,根据醋酸香豆素结构简式知,G的结构简式为
,苯酚和丙二酸酐反应生成G,E和G反应生成醋酸香豆素,根据醋酸香豆素结构简式知,G的结构简式为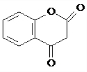 ,据此分析解答.
,据此分析解答.
解答 解:甲苯和硝酸发生取代反应生成A,根据D的结构知,A的结构简式为 ,B的结构简式为
,B的结构简式为 ,结合C相对分子质量知,C的结构简式为
,结合C相对分子质量知,C的结构简式为 ,D和丙酮反应生成E,E的结构简式为
,D和丙酮反应生成E,E的结构简式为 ,苯酚和丙二酸酐反应生成G,E和G反应生成醋酸香豆素,根据醋酸香豆素结构简式知,G的结构简式为
,苯酚和丙二酸酐反应生成G,E和G反应生成醋酸香豆素,根据醋酸香豆素结构简式知,G的结构简式为 .
.
(1)由上述分析,可知A的结构简式为 ,反应②是
,反应②是 发生卤代烃的水解反应生成
发生卤代烃的水解反应生成 ,也属于取代反应,
,也属于取代反应,
故答案为: ;水解反应或取代反应;
;水解反应或取代反应;
(2)由D的结构简式,可知含有的含氧官能团:硝基、醛基,
故答案为:硝基、醛基;
(3)反应②的化学方程式为: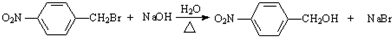 ,
,
故答案为: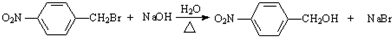 ;
;
(4)反应③的化学方程式为: ,
,
故答案为: ;
;
(5)a.醋硝香豆素的结构中含有3个苯环,故a错误;
b.E中含有碳碳双键,D中含有醛基,碳碳双键、醛基均能使酸性高锰酸钾溶液褪色,不能进行鉴别,故b错误;
c.E中含有碳碳双键、羰基、硝基,可以发生加成反应、加聚反应、氧化反应和还原反应,故c正确;
d.G中苯环、羰基与氢气发生加成反应,1molG最多可以消耗4molH2,故d错误.
故选:c;
(6)G的结构简式为 ,分子式为C9H6O3,
,分子式为C9H6O3,
故答案为:C9H6O3;
(7)G( )的某种同分异构体:①可与氯化铁溶液发生显色反应,说明含有酚羟基;②可与碳酸氢钠溶液反应生成二氧化碳气体,说明含有羧基,分子结构中只含有一个环,说明还含有碳碳三键,
)的某种同分异构体:①可与氯化铁溶液发生显色反应,说明含有酚羟基;②可与碳酸氢钠溶液反应生成二氧化碳气体,说明含有羧基,分子结构中只含有一个环,说明还含有碳碳三键,
取代基为-COOH、-C≡CH、-OH,如果-COOH、-OH位于邻位,-C≡CH有4种位置,如果-COOH、-OH位于间位,-C≡CH有4种位置,如果-COOH、-OH位于对位,-C≡CH有2种位置,
取代基为-C≡CCOOH、-OH,有邻、间、对三种结构,
符合条件的同分异构体共有13种,其中苯环上的一氯代物只有两种的同分异构体的结构简式为: ,
,
故答案为:13; .
.
点评 本题考查有机物推断与合成、官能团的结构与性质、有机反应类型、限制条件同分异构体的书写等,充分利用转化关系中有机物的结构、反应条件采取正逆推法相结合进行推断,侧重考查学生分析推断能力、知识迁移应用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Cu 2+ | B. | Fe 3+ | C. | Fe 2+ | D. | H + |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. CH3COOCH2CH3+H2O,反应类型:酯化反应或取代反应.
CH3COOCH2CH3+H2O,反应类型:酯化反应或取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海洋约占地球表面积的71%,所以地球上不缺水,人类可以随意使用水资源,不必节约 | |
| B. | 海水淡化的主要方法有蒸馏法、电渗析法、离子交换法 | |
| C. | 海水淡化的各种方法中,蒸馏法的成本比较低,可用于工业生产 | |
| D. | 污水中的重金属离子无法除去,对自然界的危害是永久的,因此要关闭重金属工业 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
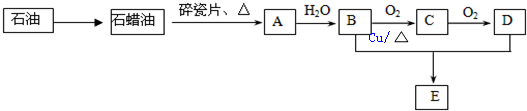
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 加入少量CH3COONa固体后,c(CH3COO-)降低 | |
| C. | 该溶液中由水电离出的 c(H+)是 1.0×10-11mol/L | |
| D. | 与等体积pH=11 的NaOH 溶液混合后所得溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象或结果 |
| I.取m g 铁粉,在水蒸气中加热一段时间 | 灰黑色铁粉变成黑色 |
| II.用排水集气法收集一小试管气体,移近到燃着 的酒精灯火焰 | 发出爆鸣声 |
| III.将黑色固体干燥、称量 | 得到n g 黑色固体 |
| IV.将黑色固体加入到过量的盐酸中 | 固体溶解,有少量气体生成,得到黄色溶液 |
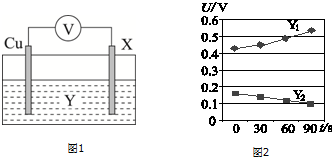
| X | U/V |
| 纯铁片 | 0.91 |
| 表面有磁性氧化铁膜的铁片 | U1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com