
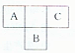
 短周期元素A、B、C,在周期表中所处的位置如图所示、A、B、C三种元素原子质子数之和为32.D元素原子的最外层电子数为其次外层电子数的2倍.则下列说法正确的是( )
短周期元素A、B、C,在周期表中所处的位置如图所示、A、B、C三种元素原子质子数之和为32.D元素原子的最外层电子数为其次外层电子数的2倍.则下列说法正确的是( )| A. | A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且反应类型相同 | |
| B. | A的气态氢化物比B的气态氢化物稳定,是由于A的氢化物分子间有氢键 | |
| C. | 元素D形成的气态氢化物一定是正四面体型分子 | |
| D. | 四种元素的原子半径:B>D>A>C |
分析 短周期元素A、B、C,结合元素周期表中所处的位置,设A的质子数为x,B的质子数为x+9,C的质子数为x+2,由A、B、C三种元素原子质子数之和为32,则x+x+9+x+2=32,解得x=7,即A、B、C分别为N、S、F;D元素原子的最外层电子数为其次外层电子数的2倍,则次外层电子数为2,最外层电子数为4,即D为C元素,以此来解答.
解答 解:由上述分析可知,A为N,B为S,C为F,D为C,则
A.A元素的气态氢化物与它们对应的最高价氧化物对应的水化物发生反应化合反应生成硝酸铵,B元素的气态氢化物与对应的最高价氧化物对应的水化物发生氧化还原反应生成S、二氧化硫和水,反应类型不相同,故A错误;
B.氢化物的稳定性与非金属性有关,与氢键无关,故B错误;
C.D形成的气态氢化物为甲烷时,是正四面体型分子,为乙烯时为平面结构,为乙炔时为直线结构,故C错误;
D.电子层越多,原子半径越大,同周期从左向右原子半径减小,则四种元素的原子半径:B>D>A>C,故D正确;
故选D.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、原子结构推断元素为解答的关键,侧重分析与应用能力的考查,注意A、C为解答的易错点,题目难度不大.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
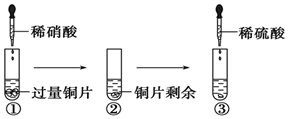 某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是
某化学兴趣小组进行有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是| A. | ①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2 | |
| B. | ③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O | |
| C. | ③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强 | |
| D. | 由上述实验可知:Cu在常温下既可与稀硝酸反应,也可与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用 | |
| B. | 向某溶液中滴加硝酸酸化的BaCl2溶液产生白色沉淀,则该溶液中含有SO42- | |
| C. | 在电解精炼铜过程中,阳极质量的减少多于阴极质量的增加 | |
| D. | 298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+0.45Fe3+0.50O | B. | Fe2+0.85Fe 3+0.10O | ||
| C. | Fe2+0.15Fe3+0.80O | D. | Fe2+0.20Fe 3+0.75O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 元素性质或原子结构信息 |
| Q | 原子核外有6种不同运动状态的电子 |
| R | 最外层电子数是次外层电子数的3倍 |
| X | 气态氢化物的水溶液呈弱碱性 |
| Y | 第三周期元素的简单离子中离子半径最小 |
| Z | 单质为银白色固体,在空气中燃烧发出黄色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
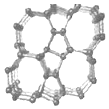
| A. | Si24是一种新型化合物 | |
| B. | Si24是硅的一种同素异形体 | |
| C. | Si24易与稀硫酸反应生成氢气 | |
| D. | 硅太阳能电池供电原理与原电池相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
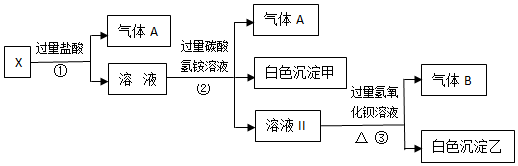
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com