
| A. | 第3周期非金属元素含氧酸的酸性从左到右依次增强 | |
| B. | HCl、H2S、PH3的稳定性逐渐减弱 | |
| C. | 第3周期自左往右原子和离子半径均依次减小 | |
| D. | 向MgCl2溶液中加入金属钠发生2Na+MgC12═2NaC1+Mg,所以金属性Na>Mg |
分析 A.第三周期非金属元素,非金属元素的非金属性越强,其最高价氧化物的水化物酸性越强,但其含氧酸的酸性不一定强;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.同一周期元素,原子半径随着原子序数增大而减小,离子电子层数越多其半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
D.将Na加入氯化镁溶液中,Na先和水反应生成NaOH和氢气,生成的NaOH再和氯化镁发生复分解反应.
解答 解:A.第三周期非金属元素,非金属元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以第三周期非金属元素随着原子序数增大而非金属性增强,其最高价氧化物的水化物酸性依次增强,但其含氧酸的酸性不一定强,如酸性H2SO3>HClO,故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S>P,所以HCl、H2S、PH3的稳定性逐渐减弱,故B正确;
C.同一周期元素,原子半径随着原子序数增大而减小,离子电子层数越多其半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以从Na到Cl其原子半径依次减小,但离子半径先减小后增大再减小,故C错误;
D.将Na加入氯化镁溶液中,Na先和水反应生成NaOH和氢气,反应方程式为2Na+2H2O=2NaOH+H2↑,生成的NaOH再和氯化镁发生复分解反应,反应方程式为2NaOH+MgCl2=Mg(OH)2↓+2NaCl,故D错误;
故选B.
点评 本题考查同一周期元素周期律,明确原子结构、元素性质及物质性质关系是解本题关键,为高频考点,注意规律中的反常现象,易错选项是AD,注意非金属性越强其“最高价”氧化物的水化物酸性越强,题目难度不大.


科目:高中化学 来源: 题型:解答题
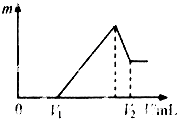 将镁、铝的混合物共0.2mol,溶于200mL 4mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.
将镁、铝的混合物共0.2mol,溶于200mL 4mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 为防止中秋月饼等富脂食品被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| C. | 对废旧电池进行回收处理主要为了防止重金属污染水源 | |
| D. | 大力推广燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
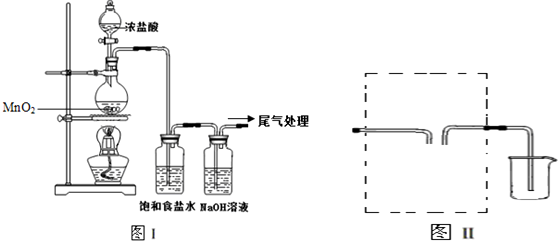
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在整个18列元素中,第1列的元素种类最多 | |
| B. | 只有第2列元素原子最外层有2个电子 | |
| C. | 第1列元素均为金属元素 | |
| D. | 第9列元素中没有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者是同一反应 | B. | 两者没有任何联系 | ||
| C. | 盐类水解反应的逆反应是中和反应 | D. | 两者互为可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
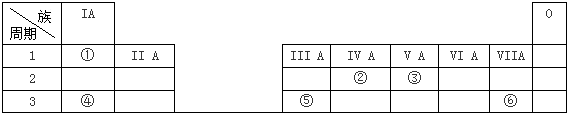
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液HCO3-+OH-═CO32-+H2O | |
| B. | 氯化铁溶液中通入硫化氢气体2Fe3++S2-═2Fe2++S↓ | |
| C. | 次氯酸钙溶液中通入过量二氧化碳Ca++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | FeCl3溶液中加入少量的HI溶液:2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com