
【题目】在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是
A. a=6.00 B. 同时改变反应温度和蔗糖的浓度,v可能不变
C. b<50 D. 50℃时,经过5s蔗糖浓度减少一半
【答案】D
【解析】A、根据表格的数据可知:在50℃时,蔗糖的浓度越大,水解的速率越快,蔗糖的浓度每减小0.1mol/L速率减小0.60mol/(L·min);在60℃时,蔗糖的浓度每减小0.1mol/L速率减小0.15mol/(L·min),所以浓度a=7.50-1.50=6.00,故A正确;B、由表格可知,影响水解速率的因素由两个,温度和浓度,升高温度,若同时改变反应物的浓度和反应的温度,则对应速率的影响因素相互抵消,反应速率可能不变,故B正确;C、在浓度相同的情况下,50℃时的速率大于b℃时的速率,所以温度b<50℃,故C正确;D、5s即![]() ,起始浓度为0.6mol/L时,水解初始速率为3.6mol/(L·min),若一直以该速率进行下去,反应
,起始浓度为0.6mol/L时,水解初始速率为3.6mol/(L·min),若一直以该速率进行下去,反应![]() ,蔗糖浓度减少0.3mol/L,浓度减半,但是在水解的过程中,平均速率应小于起始速率,故时间应大于
,蔗糖浓度减少0.3mol/L,浓度减半,但是在水解的过程中,平均速率应小于起始速率,故时间应大于![]() ,故D错误。选D。
,故D错误。选D。


科目:高中化学 来源: 题型:
【题目】常温下,下列说法正确的是
A. 0.1mol/LNaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
B. 0.1mol/LHCN和0.1mol/LNaCN的等体积混合溶液中:c(HCN)>c(Na+)>c(CN-)>c(H+)>c(OH-)
C. 0.1mol/LNa2C2O4溶液滴加HCl溶液至c(H2C2O4)=c(HC2O4-):3c(H2C2O4)>c(OH-)+c(Cl-)
D. 0.1mol/LNH4HSO4溶液滴加NaOH溶液至pH=7:c(Na+)=c(NH4+)+2c(NH3·H2O)>c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如下图,则符合条件的X、Y、Z分别是
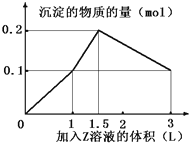
A. 偏铝酸钠、氯化钡、硫酸 B. 偏铝酸钠、氢氧化钡、硫酸
C. 氯化铝、氯化铁、氢氧化钠 D. 氯化铝、氯化镁、氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤,在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.①②③步骤的目的是从海水中提取MgCl2
C.以上提取镁的过程中涉及化合、分解和复分解反应
D.第④步电解时阴极产生氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为0.5L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g)其中容器Ⅰ中5min时到达平衡。
COCl2(g)其中容器Ⅰ中5min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法正确的是
A. 容器Ⅰ中前5min的中反应速率v(CO)=0.16mol·L-1·min-1
B. 该反应的正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55mol
D. 若起始时间容器Ⅰ中加入CO0.8mol、Cl20.8mol,达到平衡时CO的转化率大80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铅[化学式为2PbCO3·Pb(OH)2]是生产铅酸蓄电池正极的原料。
(1) 某研究小组制备碱式碳酸铅的主要实验流程如下:

①“反应①”的生成物是(CH3COO)2Pb·Pb(OH)2,该反应是在90℃、搅拌并保温3 h的条件下完成的,则该反应的化学方程式为_______________________________________。
②过滤时所需要的玻璃仪器有漏斗、________。
③沉淀经水洗涤后又用酒精洗涤的目的是____________________________________。
(2) 为确定2PbCO3·Pb(OH)2的热分解过程,进行了如下实验:
称取一定量(1)中制得的产品放在热重分析仪中,在氩气流中加热分解,测得残留固体的质量随温度的变化如下图所示。

①A→B过程中,逸出的分解产物的化学式为______________;E点残留固体的化学式为______________。
②根据图中数据,计算并确定D点残留固体的化学式(写出计算过程)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是 ( )
A. 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B. 合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率;
C. 对2HI(g)![]() H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
D. 反应CO+NO2![]() CO2+NO ΔH <0,升高温度可使平衡向逆反应方向移动
CO2+NO ΔH <0,升高温度可使平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑
B.Cu与稀硝酸的反应 3Cu+8H++2NO3﹣═3Cu2++2NO↑+4H2O
C.CaCO3与盐酸反应 CO32﹣+2H+═CO2↑+H2O
D.实验室用浓盐酸和二氧化锰反应 MnO2+2H++2Cl﹣═Mn2++Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2 ![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A. 一个N≡N键断裂的同时,有3个H—H键断裂
B. 其他条件不变时,N2浓度不再改变
C. 恒温恒容时,密度保持不变
D. 反应混合物中N2和H2的物质的量之比为1:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com