
分析 I.(1)基态N原子中电子在2p轨道上的排布遵循的原则是洪特规则,N2F2分子中N原子之间形成N=N双键,N原子与F原子之间形成N-F键,N原子含有1对孤对电子;
(2)Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大;
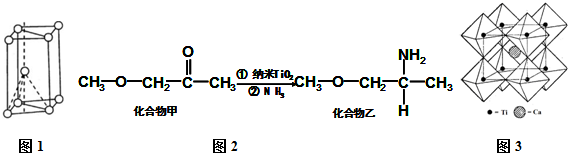
II.(1)核外电子没有运动状态相同的电子;由金属钛晶胞结构可知,属于六方最密堆积;
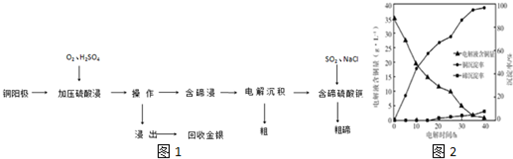
(2)化合物甲与化合物乙均为分子晶体,但化合物乙分子间可形成氢键;化合物乙中C、N、O三种原子的杂化轨道形成均为sp3,同周期自左而右电负性增大;
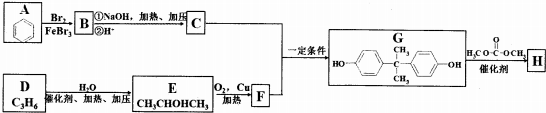
(3)钛晶矿晶胞中钛离子与周围六个氧原子包围形成八面体,立方体晶胞共有12个边长,每条边长的中点是一个氧原子,共12个氧原子包围着中心的钙离子,根据均摊法计算图中立方体中各原子数目确定化学式;
若氧离子半径为a pm,则正八面体的棱长为2a pm,则2个正四面体的连接面为正方形,该正方形棱长为2a pm,Ti位于正方形的中心,两个钛离子间最短距离等于正方形对角线长度,图中立方体中心钙离子与顶点上钛离子之间距离最短,为体对角线长度的$\frac{1}{2}$.
解答 解:(1)基态N原子中电子在2p轨道上的排布遵循的原则是洪特规则,
N2F2分子结构式为F-N=N-F,分子中N原子含有1对孤对电子,N原子的杂化方式是sp2杂化,l mol N2F2含有3molσ键,
故答案为:洪特规则;sp2杂化;3;
(2)Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N键角为109°28′,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′,
故答案为:>;Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N键角为109°28′,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′;
Ⅱ(1)Ti原子核外电子数为22,核外共有22种运动状态不相同的电子;由金属钛晶胞结构可知,属于六方最密堆积;
故答案为:22;六方最密;
(2)化合物乙因分子间存在氢键,则化合物乙的沸点比化合物甲高,化合物乙中C、N、O三种原子的杂化轨道形成均为sp3,同周期自左而右电负性增大,故电负性:O>N>C,
故答案为:化合物乙分子间形成氢键;O>N>C;
(3)钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子包围;每个晶胞中钛离子和钙离子均为1个,晶胞的12个边长上各有一个氧原子,根据均摊原则,每个晶胞实际占有氧原子数目为12×$\frac{1}{4}$=3,则晶胞的化学式为CaTiO3,
若氧离子半径为a pm,则正八面体的棱长为2a pm,则2个正四面体的连接面为正方形,该正方形棱长为2a pm,Ti位于正方形的中心,两个钛离子间最短距离正方形对角线长度,故两个钛离子间最短距离为2$\sqrt{2}$a pm,图中立方体中心钙离子与顶点上钛离子之间距离最短,为体对角线长度的$\frac{1}{2}$,则二者最短距离为$\frac{1}{2}$×$\sqrt{3}$×2$\sqrt{2}$a pm=$\sqrt{6}$a pm,
故答案为:6;12;CaTiO3;2$\sqrt{2}$a;$\sqrt{6}$a.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化轨道与空间构型、化学键、氢键、电负性、晶胞结构与计算等,Ⅱ(3)中晶胞结构与计算为易错点、难点,需要显示具备一定的空间想象与数学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +2ROH$\stackrel{催化剂}{→}$
+2ROH$\stackrel{催化剂}{→}$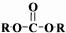 +2CH3CHOH(R为烃基)
+2CH3CHOH(R为烃基)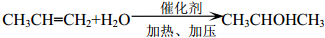 .
.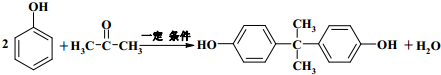 .
.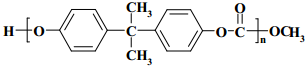 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
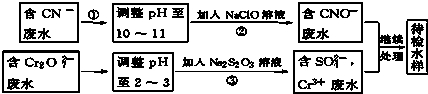
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
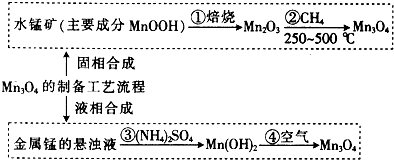
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
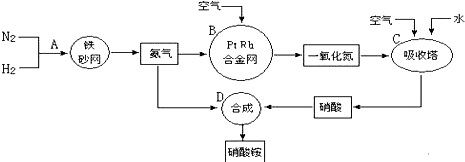
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;D的核磁共振氢谱共有3组峰.
;D的核磁共振氢谱共有3组峰.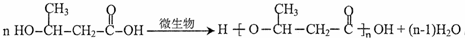 .
. 的合成路线图为
的合成路线图为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com