
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
分析 Ⅰ.(1)化学反应中一种反应物过量目的是促进其他反应物充分反应,提高转化率;
(2)温度较高时,双氧水易分解,甲醛易挥发;
(3)重金属离子与硫离子反应生成难溶的硫化物;
(4)搅拌是使反应物充分接触;甲酸钙水解显碱性,溶液为弱碱性能抑制其水解;
Ⅱ.该实验首先要去除杂质,同时生成可溶性钙盐,杂质中亚铁离子首先要氧化为铁离子(双氧水或硝酸),再生成氢氧化铁除去,铝离子也要生成碱除去,故调节pH为5(用石灰水调节);然后加入甲酸钠溶液混合生成溶解度较小、随温度变化不明显是甲酸钙,经蒸发浓缩,得到甲酸钙固体,趁热过滤,防止其它晶体析出.
解答 解:Ⅰ.(1)化学反应中一种反应物过量目的是促进其他反应物充分反应,提高转化率,则加过量的过氧化氢能使甲醛充分氧化,提高甲醛的利用率和产品纯度;
故答案为:使甲醛充分氧化,提高甲醛的利用率和产品纯度;
(2)温度较高时,双氧水易分解,甲醛易挥发,则反应温度最好控制在30-70℃之间,温度不易过高,能防止H2O2分解和甲醛挥发;
故答案为:防止H2O2分解和甲醛挥发;
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,硫化钠与重金属离子结合生成硫化物,硫化物难溶于水,可以除去重金属离子;
故答案为:除去重金属离子;
(4)搅拌是使使反应物充分接触,使其反应完全,提高产率;甲酸根离子为弱酸根离子,则甲酸钙水解显弱碱性,调节溶液pH 7~8,溶液为弱碱性能抑制甲酸钙水解,故答案为:使反应物充分接触,提高产率;防止甲酸钙水解;
Ⅱ.该实验首先要去除杂质,同时生成可溶性钙盐,杂质中亚铁离子首先要氧化为铁离子(双氧水或硝酸),再生成氢氧化铁除去,铝离子也要生成碱除去,故调节pH为5(用石灰水调节);然后加入甲酸钠溶液混合生成溶解度较小、随温度变化不明显是甲酸钙,经蒸发浓缩,得到甲酸钙固体,趁热过滤,防止其它晶体析出,
则具体的步骤为:
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用;
步骤2.用稍过量硝酸溶解碳酸钙样品;
步骤3.用石灰水调整溶液pH=5;
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、趁热过滤、洗涤、60℃时干燥得甲酸钙晶体,
故答案为:用稍过量硝酸溶解碳酸钙样品;用石灰水调整溶液pH=5;趁热过滤.
点评 本题是一道实验综合题,主要考查了物质的制备、除杂质、提高产率的方法、实验方案设计,题目难度中等,涉及实验操作目的、原理、步骤等知识,明确实验目的及实验原理为解答关键,试题培养了学生的分析能力及化学实验能力.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-4 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
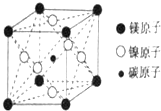 最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性.因这三种元素都是常见元素,从而引起广泛关注.该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )
最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性.因这三种元素都是常见元素,从而引起广泛关注.该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )| A. | MgCNi3 | B. | Mg2CNi3 | C. | MgCNi2 | D. | MgC2Ni |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向淀粉溶液中加入少量的稀硫酸,加热几分钟,冷却后再向该溶液中加入新制Cu(OH)2.没有红色沉淀生产,说明淀粉没有水解 | |
| B. | .向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去. 则使溶液褪色的气体是乙烯 | |
| C. | CO2通入到饱和的Na2CO3溶液中有晶体析出,则晶体为NaHCO3 | |
| D. | 检验Fe2+时,加入KSCN溶液后,发现溶液变红,则Fe2+已被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、C1-、$SO_4^{2-}$、K+ | B. | H+、S2-、Na+、NO3- | ||
| C. | Ca2+、$HCO_3^-$、C1-、K+ | D. | Ag+、$NO_3^-$、Cl-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 115号元素位于周期表第八周期 | |
| B. | 该115号的元素的这种核素的原子中,中子数与电子数之差为174 | |
| C. | 1个115号元素的原子与1个12C原子质量之比为115:12 | |
| D. | 115号元素可显+5价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com