
����Ŀ��ʵ����Ҫ����100mL1.0mol��L��1��NaCl��Һ���Իش����и��⡣
(1)�����㣬Ӧ����������ƽ��ȡNaCl����_________g��
(2)����NaCl����������Һ�����������У�����Ҫ�õ�����_________(�����)��
A.��ƿ��B.200mL����ƿ��C.�ձ���D.��ͷ�ιܣ�E.ҩ�ף�F.������ƽ��G.ϴƿ
(3)��Ҫʵʩ���ƣ������������⣬��ȱ����������Ʒ��_________��_________��
(4)��ʹ��ǰ����������ƿ�Ƿ�______��
(5)���ƹ��������²�����A.��Һ B.���� C.ϴ�� D.���� E.�ܽ� F.ҡ�ȡ�����ȷ�IJ���˳��Ӧ��_________ (�����)��
(6)���������������ᵼ��������ҺŨ��ƫ�ߵ���______(�����)��
A.����ʱ��������ƿ�̶���
B.����ʱ��������ƿ�̶���
C.���ܽ���ȴ����Һת������ƿ���ֱ��ת�붨�ݲ���
D.���ݺ�����ƿ����ҡ�Ⱥ���Һ����ڿ̶��ߣ��㲹�伸��ˮ���̶ȴ�
(7)��ʵ������г������������δ�����������ˮʱ���������˿̶ȣ�______��
���𰸡�5.9 AB ������ 100mL����ƿ ©ˮ B��E��A��C����A����D��F B Ӧ������Һ��ϴ������ƿ����������
��������
(1)����n=cVM��������100mL 1.0molL-1��NaCl��Һ��Ҫ�Ȼ���������
(2)����ʵ������IJ���(���㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ���)ѡ����Ҫ�����������жϲ���Ҫ��������
(3)����ʵ������IJ���(���㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ���)ѡ����Ҫ�����������ж�ȱ��������
(4)��������ƿ�Ľṹ��ʹ�÷���������
(5)����ʵ������IJ���(���㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ���)��������
(6)�����������������ʵ�������Һ�����Ӱ�죬����c=![]() ����������������ҺŨ�ȵ�Ӱ�죻
����������������ҺŨ�ȵ�Ӱ�죻
(7)������ˮʱ���������˿̶ȣ������ȣ�Ӧ������Һ��ϴ������ƿ���������ơ�
(1)����100mL1.0molL-1��NaCl��Һ��Ҫ�Ȼ�������Ϊ1.0molL-1��0.1L��58.5g/mol=5.9g��
(2)ʵ������IJ����м��㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ����������ƽ��������ҩ��ȡ��ҩƷ�����ձ����ܽ⣬���ò��������裬�ָ����º�ת�Ƶ�100mL����ƿ�У����ò�����������ϴ���ձ��Ͳ�����2��3�Σ�����ϴ��Һ��������ƿ�У���������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμ�ˮ����Һ����̶���ˮƽ���У��Ǻ�ƿ���������ߵ�����ҡ�ȣ������Լ�ƿ����ǩ���棻������Ҫ������Ϊ��������ƽ��ҩ�ס��ձ�����������100mL����ƿ����ͷ�ιܣ�������ϴƿ��ˮ���ʲ���Ҫ�õ��������У�A����ƿ��B��200mL����ƿ����ѡ��AB��
(3)��(2)�еIJ��������֪��������Ҫ������Ϊ��������ƽ��ҩ�ס��ձ�����������100mL����ƿ����ͷ�ιܣ��ʻ�ȱ�ٵ�����Ϊ����������100mL����ƿ��
(4)����ƿƿ���в�������ʹ��ʱ��Ҫ�ߵ�ҡ�ȣ�����ʹ��ǰ����������ƿ�Ƿ�©ˮ��
(5)��(2)�еIJ��������֪����ȷ�IJ���˳��ΪB��E��A��C��(A)��D��F��
(6)A������ʱ��������ƿ�̶��ߣ�����������Һ���ƫ��������Һ��Ũ��ƫ�ͣ���A�����ϣ�
B������ʱ��������ƿ�̶��ߣ�����������Һ�����ƫС��������Һ��Ũ��ƫ�ߣ���B���ϣ�
C�����ܽ���ȴ����Һ��ת������ƿ���ֱ��ת�붨�ݲ������ձ��Ͳ������в���������û��ת��������ƿ�������ܶ�ƫ�ͣ���C�����ϣ�
D�����ݺ�����ƿ����ҡ�Ⱥ���Һ����ڿ̶��ߣ�������Һ������ƿ����ƿ��֮�䣬���伸��ˮ���̶ȴ���ʹ������Һ�����ƫ��������ҺŨ��ƫ�ͣ���D�����ϣ�
�ʴ�ΪB��
(7)������ˮʱ���������˿̶ȣ���Һ�����ƫ��������ҺŨ��ƫ�ͣ������ȣ�Ӧ������Һ��ϴ������ƿ���������ơ�


 С��ſ�ʱ��ҵϵ�д�
С��ſ�ʱ��ҵϵ�д� һ������ϵ�д�
һ������ϵ�д� �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д� �¸��̵�ѧϵ�д�
�¸��̵�ѧϵ�д� ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������X��������Ԫ�أ���198�����±Ƚ��ȶ����¶ȸ�ʱ�ֽ⣮��ij�о�С����Ʋ��������ʵ�飺
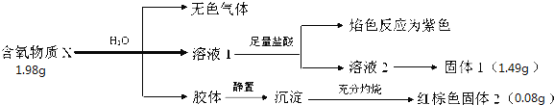
�Իش��������⣺
��1��X�Ļ�ѧʽΪ__________��д��X��H2O��Ӧ�����ӷ���ʽ__________________
��2����ҵ���ɺ���ɫ����2�����Ʊ��䵥�ʣ�д����ѧ����ʽ____________________
��3������XʱӦע��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����CuO��KHC2O4��Һ��Ӧ�ĵ�����ɫ�ᾧ��KaCub(C2O4)cdH2O�ݡ�Ϊ�ⶨ����ɣ�����������ʵ�飺
����1��ȡ3.5400 g�þ��壬�������ϡ���ᣬ����Ʒ��ȫ�ܽ���������ˮ�����Ƴ�100 mL��ҺA.
����2��ȡ20.00 mLA��Һ���μ�0.2000 mol L-1 KMnO4��Һ��ǡ����ȫ��Ӧʱ������KMnO4��Һ8.00 mL��
����3��ȡ20.00 mLA��Һ����������NaOH��Һ����ַ�Ӧ�����ˡ�ϴ�ӡ����ա����أ��õ���ɫ�����ĩ0.16 g��
��֪������2 �з�����Ӧ��2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ +10CO2�� + 8H2O��
��1������1��������ҺAʱ����Ҫ�õ��IJ����������ձ�����������_____��
��2��3.5400 g ����Ʒ�к� n(C2O42-)= ____mol��
��3��3.5400 g ����Ʒ�к� n(Cu2+)= ____mol��
��4��ͨ������ȷ������ɫ����Ļ�ѧʽ__________(�������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1g������������ȼ������Һ̬ˮ���ų�142.9kJ����������ʾ�÷�Ӧ���Ȼ�ѧ����ʽ�ǣ���
A.H2(g)+![]() O2 (g)=H2O(l) ��H=-285.8kJ��mol-1
O2 (g)=H2O(l) ��H=-285.8kJ��mol-1
B.H2(g)+![]() O2 (g)=H2O(g) ��H=-285.8kJ��mol-1
O2 (g)=H2O(g) ��H=-285.8kJ��mol-1
C.2H2(g)+O2(g)=2H2O(l) ��H=-285.8kJ
D.H2+![]() O2=H2O ��H=-285.8kJ��mol-1
O2=H2O ��H=-285.8kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��ϩ��ʹ���Ը��������Һ��������Ȼ�̼��Һ��ɫ�����У��������ط����ķ�Ӧ��________��Ӧ(�Ӧ���ͣ���ͬ)�����巢���ķ�Ӧ��________��Ӧ����һ���������£���ϩ���ܷ���________��Ӧ�����ɾ���ϩ��
(2)һ����ʹ��ˮ��ɫ����̬������״����5.6 L������Ϊ10.5 g,10.5 g������ȫȼ��ʱ����16 .8 L������̼��13.5 gˮ��������ķ���ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����г�����Ҫ�Ի�������е�NOx�������вⶨ������һ�ַ����IJ������£��ٽ�200L����ͨ���ữ��H2O2��Һ�У�ʹNOx��ȫ������ΪNO![]() ����ˮϡ����100.00mL�������ȣ���ȥ������H2O2������ȡ20.00mL����Һ������20mL8.000��10-2mol��L-1FeSO4��Һ������������ַ�Ӧ������5.000��10-3mol��L-1K2Cr2O7��Һ�ζ�ʣ���Fe2+���յ�ʱ����20.00mL��
����ˮϡ����100.00mL�������ȣ���ȥ������H2O2������ȡ20.00mL����Һ������20mL8.000��10-2mol��L-1FeSO4��Һ������������ַ�Ӧ������5.000��10-3mol��L-1K2Cr2O7��Һ�ζ�ʣ���Fe2+���յ�ʱ����20.00mL��
��1����ʹ�����е�NOx���õر�H2O2��Һ�����IJ�����___��
��2��NO��H2O2����ΪNO3-�����ӷ���ʽ��___��
��3����ȱ�ٲ���ڣ��Ի��������NOx�����IJⶨ�����___������ƫ��������ƫС��������Ӱ��������
��4���ζ������з������з�Ӧ��δ��ƽ����
Fe2++NO![]() +H+����NO��+Fe3++H2O
+H+����NO��+Fe3++H2O
Cr2O![]() +Fe2++H+����Cr3++Fe3++H2O
+Fe2++H+����Cr3++Fe3++H2O
��������NOx�ۺϳ�NO2�ĺ���Ϊ___mg��m-3��������4λ��Ч���֣���д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֽ�������A��B��C������A����ɫ��ӦΪ��ɫ��B��C�dz������������ֽ�������A��B��C������ס��ҡ���������D��E��F��G��H֮�䷢������ת����ϵ(ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û�б��)��
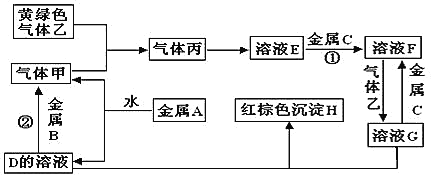
�����������Ϣ�ش��������⣺
(1)д���������ʵĻ�ѧʽ��A__________�� G___________��
(2) д����Ӧ�ٵĻ�ѧ����ʽ��__________��д����Ӧ�ڵ����ӷ���ʽ��_________��
(3)˵������ɫ�����ҵ�һ����;__________________��
(4)����E��F������Һ��ķ�����______��ʵ���Ҽ���G�������Ľ�������ʱ������G����Һ�м���_____��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ���������ֵ������˵����ȷ����( )
A. ����1molFeCl3����Һ�����ˮ�У����Ƶõ�Fe(OH)3��������ΪNA
B. ���³�ѹ�£�1 mol��(-CH3)����������Ϊ10NA
C. ���³�ѹ�£�92g��NO2��N2O4������庬�е�ԭ����Ϊ6NA
D. ��״���£�11.2L���ȼ����к��еļ��Թ��ۼ���ĿΪ1.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20 L���ܱ������а����ʵ���֮��Ϊ1��2����CO��H2��������Ӧ��CO(g)��2H2(g)![]() CH3OH(g)����H�����CO��ת�������¶ȼ���ͬѹǿ�µı仯��ͼ��ʾ��p2��195 ��ʱn(H2)��ʱ��ı仯��������ʾ������˵����ȷ����(����)
CH3OH(g)����H�����CO��ת�������¶ȼ���ͬѹǿ�µı仯��ͼ��ʾ��p2��195 ��ʱn(H2)��ʱ��ı仯��������ʾ������˵����ȷ����(����)
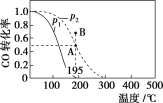
p2��195 �� ʱn(H2)��ʱ��仯
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
A. p1��p2����H��0
B. ��p2��195 �� ʱ����Ӧǰ3 min��ƽ������v(CH3OH)��0.8 mol��L��1��min��1
C. ��p2��195 �� ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ25
D. ��B ��ʱ��v����v��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com